Первая цифра огрн 5
Основной государственный регистрационный номер: что это?
На сегодняшний день всем организациям при регистрации присваивается немалое количество различных идентификаторов и номеров.
О расшифровке номера
Следующие пять цифр («50978») – это номер записи, которая была внесена соответствующим органом в государственный реестр.
А для чего же нужна последняя цифра? Это так называемое контрольное число. Каким образом его получают?
Читайте далее — форма доверенности на получение ТМЦ. Подробная статья.
В новости (ссылка) классификатор ОКВЭД.
Несколько слов об ОГРНИП
Как узнать ОГРН?
Рассмотрим пошагово порядок действий для определения ОГРН:
Укажем некоторую специфику поисковой системы сайта ФНС:
Что такое акт списания материалов? Зачем его используют и как?
В статье (тыц) гарантийное письмо на выполнение работ.
Завершая рассмотрение ОГРН, отметим некоторые положения:
Видео на тему: «Проверить ОГРН ИП»
Не нашли ответа на свой вопрос? Узнайте, как решить именно Вашу проблему — позвоните прямо сейчас:
+7 (499) 288-16-54 (Москва)
+7 (812) 317-55-94 (Санкт-Петербург)
Расшифровка и проверка кодов ОГРН
Расшифровка аббревиатуры и кода ОГРН
Что же означает и как расшифровывается аббревиатура ОГРН?
Как расшифровать код ОГРН
На первом месте в основном регистрационном гос номере также могут находиться числа «2» и «3».
- Осталась последняя цифра. Она не включает в себя каких-либо обозначений, а является
Этот остаток и будет контрольным значением, записываемым как последнее число ОГРН.
Для проверки подлинности госномера применяется контрольное число.
ОГРНИП: чем отличается ОГРН для индивидуальных предпринимателей
Свидетельство ОГРН
На свидетельстве, утверждающем внесение ОГРН в ЕГРЮЛ, указываются:
Что делать, если утерян бланк свидетельство ОГРН ?
- Реквизиты получателя гос пошлины можно узнать как в самой ИФНС, так и на официальном сайте налоговой службы.
- После оплаты гос пошлины необходимо написать заявление, адресуемое начальнику соответствующего регистрационного органа ФНС.
Как проверить ОГРН
Как подтвердить или узнать подлинность ОГРН компании и организации?
Установить, настоящий ли регистрационный номер указан организацией, можно следующими путями:
Как выяснить ОГРН при помощи сети интернет
Самый быстрый и удобный способ узнать ОГРН – воспользоваться официальным порталом федеральной налоговой службы.
Чтобы это сделать, вам потребуется выполнить следующие действия:
Если вы нашли ошибку, пожалуйста, выделите фрагмент текста и нажмите Ctrl+Enter.
- Поделитесь с друзьями:
Понравилась статья? Подписывайтесь на обновления сайта по RSS, или следите за обновлениями Facebook, ВКонтакте, Одноклассниках, Google Plus или Twitter.
Подписывайтесь на обновления по E-mail:
- Сергей | 14.08.2016 в 10:32:43
Добавить комментарий
Отменить ответДля отправки комментария вам необходимо авторизоваться.
Что означает ОГРН начинается на цифру «5»?
1 ответ на вопрос от юристов 9111.ru
Понятно, но при этом эта организация с ОГРН на «5» называет себя «Государственное Бюджетное Учреждение! Это УК Жилищник.
Анна, лично я никогда не работала в налоговых органах и точной расшифровки значения всех цифр номера не знаю.
Это вопрос скорее к налоговым органам, чем к юристам, поскольку именно они формируют регистрационные номера.
Но ГБУ Жилищники есть с нумерацией ОГРН начинающейся на цифру 1 и 5.
Первая цифра огрн 5
Актуально на: 16 апреля 2018 г.
Как расшифровывается ОГРН
Как выглядит ОГРН? ОГРН представляет собой набор цифр, некоторые из которых несут в себе определенную информацию.
ОГРН: сколько цифр
Посмотрим, как расшифровать значение символов в ОГРН (п. 7 Порядка ведения ЕГРЮЛ и ЕГРИП ):
Проверка ОГРН: пример расчета контрольного числа
Допустим, ОГРН юридического лица такой: 1037727038315. Проверим, действительно ли контрольное число должно быть равно 5.
1) 103772703831 / 11 = 9433882166,45455
2) 9433882166 х 11 = 103772703826
3) 103772703831 – 103772703826 = 5.
Есть ли ОГРН у ИП
Что такое ОГРН и как узнать его номер
ОГРН – идентификатор, присваиваемый всем организациям с 2002 года. Это уникальное для каждого предприятия или индивидуального предпринимателя цифровое значение вносится в единый государственный реестр.
Оглавление статьи
ОГРН организации и ОГРНИП
[ads-pc-3] [ads-mob-3]Информация об основном государственном регистрационном номере является общедоступной и открытой любому интересующимся лицу. Это значит, что каждый обратившийся в налоговые органы с заявлением о предоставлении сведений об организации с соответствующим номером может узнать такие сведения. Одновременно с этим можно узнать ОГРН по ИНН или любым другим из нижеописанных способов.
Это значит, что каждый обратившийся в налоговые органы с заявлением о предоставлении сведений об организации с соответствующим номером может узнать такие сведения. Одновременно с этим можно узнать ОГРН по ИНН или любым другим из нижеописанных способов.
Такой идентификатор несет зашифрованную информацию, в которой содержатся следующие данные:
- Первая цифра ОГРН и ОГРНИП является показателем того, что организация зарегистрирована в реестре, при этом число «2» присваивается государственным учреждением, а число «1» идентифицирует объект в качестве ИП.
- Две последующие цифры – год регистрации в налоговых органах.
- Цифры с четвертой по седьмую включительно «расскажут» о регионе регистрации и о конкретном отделении налоговой соответственно.
- Пять цифр с восьмой по двенадцатую являются присвоенным решению о регистрации номером.
- Тринадцатая контрольная цифра ничего не обозначает и служит для проверки кода на подлинность.

Код для организаций и для индивидуальных предпринимателей отличается лишь тем, что во втором случае цифр не тринадцать, а пятнадцать. В остальном у ОГРНИП и ОГРН расшифровка не отличается.
Где используется
ОГРН позволяет получить практически полные сведения об организации, в том числе – узнать, кто является ее руководителем, где компания находится и существует ли она вообще, а также выяснить, нет ли обладателя ОГРН в «черных списках», которые составляются налоговыми органами. В такие списки входят различные фирмы-однодневки и компании, имеющие задолженности по налоговым выплатам.
Как узнать
[ads-pc-3] [ads-mob-3]У ОГРН и ОГРНИП расшифровка несколько отличается из-за количества знаков, однако все эти данные содержатся в одном месте, поэтому узнать при необходимости такой идентификатор в любом случае можно тремя способами:
- запросив выписку из налоговой инспекции, в этом случае данные предоставляются в течение недели после регистрации запроса;
- посмотреть номер в свидетельстве о регистрации предприятия или ИП;
- узнать ОГРН по ИНН, воспользовавшись интернет-сервисом.

В первом случае заинтересованному лицу не нужно иметь никаких специальных разрешений, и даже необязательна причина. ОГРН относится к открытой информации, и чтобы оформить запрос, вам нужно только предъявить свое удостоверение личности в отделении налоговой.
Зачем нужна проверка
Если ОГРН или ОГРНИП предоставлены не налоговой и взяты не из официального документа, может существовать вероятность того, что идентификатор недействителен или является поддельным. Убедиться в обратном поможет простая проверка ОГРН, которая состоит из нескольких этапов:
- Числовое значение ОГРН, которым вы располагаете, выпишите на бумагу без последней контрольной цифры (это 13 и 15 знак для организации и ИП соответственно).
- Полученное двадцатизначное число разделите на 11.
- Получив дробное число, сократите его до целого, отбросив дробное значение, и результат также выпишите на лист бумаги, обозначив это значение как «первое».
- Умножьте это «первое значение» на 11, получив «второе».

- Отняв из «первого» «второе», вы получите ту самую контрольную цифру.
Если вы все сделали правильно и ОГРН действительно подлинный – результат ваших вычислений всегда совпадет с контрольным значением. В противном случае необходимо проверить организацию, которой принадлежит «подозрительный» идентификатор.
Вам также может понадобитьсяЧто такое ОКТМО и как его узнать.
Для чего нужен ОКПО и как его узнать.
Что означает регистрационный номер индивидуального предпринимателя?
После проведения процедуры государственной регистрации предприятия, оно подлежит бесперебойному контролю со стороны органов государственной власти, обладающих полным спектром административных полномочий. Контролирующие органы ведут специализированные реестры всех форм осуществления предпринимательской деятельности. Для наибольшего удобства государство ввело правило, согласно которому каждая организационная форма предпринимательской деятельности получает индивидуальный числовой код, используя который каждое заинтересованное лицо имеет возможность получить необходимые сведения о субъекте предпринимательской деятельности. Такой уникальный числовой код, который получает предприниматель после его регистрации, называется государственный регистрационный номер индивидуального предпринимателя.
Для наибольшего удобства государство ввело правило, согласно которому каждая организационная форма предпринимательской деятельности получает индивидуальный числовой код, используя который каждое заинтересованное лицо имеет возможность получить необходимые сведения о субъекте предпринимательской деятельности. Такой уникальный числовой код, который получает предприниматель после его регистрации, называется государственный регистрационный номер индивидуального предпринимателя.
 Если ИНН, который указан в Свидетельстве о постановке юридического лица на налоговый учет, помогает узнать довольно большой спектр информации о нем, то основной регистрационный номер содержит только ограниченное количество информационных данных. Основной регистрационный номер также может именоваться как код ОГРН или просто ОГРН.
Если ИНН, который указан в Свидетельстве о постановке юридического лица на налоговый учет, помогает узнать довольно большой спектр информации о нем, то основной регистрационный номер содержит только ограниченное количество информационных данных. Основной регистрационный номер также может именоваться как код ОГРН или просто ОГРН.ОГРН представляет комбинацию тринадцати чисел. Каждая цифра несет конкретную информацию о предпринимателе или юридическом лице. Наиболее подробно рассмотрим значение и смысл каждого числового значения в номере.
Следующие две цифры покажут информацию, в каком году был зарегистрирован предприниматель.

О регионе страны, где хозяйствующий субъект официально зарегистрировался, покажут четвертая и пятая цифры.
Информацию о налоговом органе, в котором был зарегистрирован предприниматель, содержат в коде ОГРН шестая и седьмая цифры.
Восьмая, девятая, десятая, одиннадцатая и двенадцатая означают порядковый номер принятого решения о регистрации предпринимателя. Именно сочетание этих числовых значений для предприятий является уникальным и таким образом организации подлежат индивидуализации.
Последнее число является частным от деления значения, состоящего из первых двенадцати цифр на одиннадцать.
Если рассматривать такого субъекта хозяйственной деятельности как индивидуального предпринимателя, то его основной регистрационный номер будет состоять не из тринадцати, а из пятнадцати цифр.
 Код ОГРНИП не подлежит изменению даже при внесении предпринимателем изменений в данные, указанные им при обращении в налоговую инспекцию за проведением государственной регистрации.
Код ОГРНИП не подлежит изменению даже при внесении предпринимателем изменений в данные, указанные им при обращении в налоговую инспекцию за проведением государственной регистрации.Отличием ОГРНИП от ОГРН других предприятий производится на основании порядкового номера решения налоговой инспекции о проведении государственной регистрации в этом статусе. Если у предприятий порядковый номер записи состоит из пяти чисел, то для индивидуального предпринимателя он состоит из девяти числовых значений.
Полезные статьи:
Индивидуальный предприниматель пенсионер
Вопросы о регистрации ИП по месту прописки
Персонифицированный учет ИП
КПП сколько цифр у юридического лица: дата постановки на учет
Что означают цифры ИНН и КПП
Актуально на: 6 июня 2017 г.
ИНН и КПП – это цифровые коды, которые присваиваются организациям. У предпринимателей есть только ИНН (иногда его еще назвают «индивидуальный номер налогоплательщика» или «идентификатор налогоплательщика»), КПП им не присваивается.
Что означает ИНН
Идентификационный номер налогоплательщика присваивается организациям при первичной постановке на учет в ИФНС. В течение всей «жизни» организации ИНН не меняется, даже при переходе организации в другую инспекцию. ИНН указывается в свидетельстве о постановке на налоговый учет (Порядок, утв. Приказом ФНС от 29.06.2012 № ММВ-7-6/435@).
Сколько цифр в ИНН? У организаций – 10 цифр (а вот у предпринимателей – 12 цифр).
Найти данные по ИНН можно на сайте ФНС России с помощью сервиса «Риски бизнеса: проверь себя и контрагента». Там любую организацию можно идентифицировать по ОГРН/ИНН или по наименованию.
Что означают цифры ИНН
Важно знать лишь, что означают первые цифры ИНН:
- первая и вторая цифры показывают субъект РФ, в котором была зарегистрирована организация;
- третья и четвертая цифры показывают код ИФНС, в которой организация вставала на учет.
Например, ИНН 7702123456 означается, что организация при создании встала на учет в московской ИФНС № 2.
Коды статистики по ИНН
По ИНН можно узнать все коды, присваиваемые органами Росстата (ОКПО, ОКТМО, ОКАТО и т.д.). Документ с кодами можно распечатать с сайта территориального отделения Росстата.
Что означает КПП организации
КПП – это 9-значный цифровой код, присваиваемый организациям (Порядок, утв. Приказом ФНС от 29.06.2012 № ММВ-7-6/435@). Что означают цифры КПП?
| Какие цифры КПП | Что означают эти цифры КПП |
|---|---|
| Первые и вторая цифры | Код региона РФ (или 99 для межрегиональных инспекций ФНС) |
| Третья и четвертая цифры | Номер ИФНС, поставившей организацию на учет |
| Пятая и шестая цифры | Код причины постановки на учет |
| Седьмая, восьмая и девятая цифры | Порядковый номер постановки на учет по конкретной причине |
Например, КПП 770201001 означает, что организация находится в Москве, стоит на учете в ИФНС России № 2 по г. Москве в качестве налогоплательщика по месту своего нахождения.
Москве в качестве налогоплательщика по месту своего нахождения.
При смене места нахождения, при постановке на учет по месту нахождения недвижимости или транспорта и т.д. у организации может появиться новый КПП. Расшифровка КПП, к сожалению, нигде не приведена. Но мы покажем наиболее распространенные коды причины постановки на учет.
| Код | Причина постановки на учет |
|---|---|
| 01 | Регистрация организации по месту нахождения |
| 43 | Регистрация филиала российской компании |
| 44 | Регистрация представительства российской компании |
| 45 | Регистрация обособленного подразделения российской компании |
| 50 | Постановка на учет в качестве крупнейшего налогоплательщика |
Что означает КПП в реквизитах счетов, счетов-фактур и других документов? В принципе над этим можно и не задумываться. Если вы перечисляете организации деньги или выставляете в ее адрес какие-либо документы, то просто перенесите указанный самой организацией КПП в ваш документ.
Но имейте в виду, если какая-то организация продает товары через свое обособленное подразделение, то в счетах-фактурах она должна указать КПП обособленного подразделения. А вот в строках 2 и 2а указываются наименование и ИНН самой организации (Письмо Минфина от 18.05.2017 № 03-07-09/30038). Это важно, поскольку при нарушении этих требований вам могут отказать в вычете входного НДС по неправильно оформленному счете-фактуре.
Как узнать КПП
Узнать КПП по ИНН организации просто. На сайте ФНС есть сервис «Риски бизнеса: проверь себя и контрагента». Укажите там известный вам ИНН организации и вам покажут КПП юридического лица по месту его нахождения.
Кстати, некоторые пользователи информации задаются вопросом: идентификационный номер налогоплательщика учредителей, что это? Так вот ИНН учредителей фирмы также можно узнать при помощи названного сервиса — достаточно ознакомиться с выпиской из ЕГРЮЛ интересующей компании.
Как узнать дату присвоения ИНН в налоговой службе?
ИНН присваивается при первичной постановке гражданина на учет в налоговом органе по месту жительства, а при отсутствии такового — по месту пребывания. При отсутствии на территории РФ и места жительства, и места пребывания ИНН присваивается по месту нахождения недвижимости или транспортного средства на территории РФ. В указанных случаях постановка гражданина на налоговый учет осуществляется на основании либо его заявления в любой налоговый орган, либо информации, представляемой в налоговую инспекцию соответствующими органами.
При отсутствии на территории РФ и места жительства, и места пребывания ИНН присваивается по месту нахождения недвижимости или транспортного средства на территории РФ. В указанных случаях постановка гражданина на налоговый учет осуществляется на основании либо его заявления в любой налоговый орган, либо информации, представляемой в налоговую инспекцию соответствующими органами.
Если гражданин без места жительства и места пребывания не имеет недвижимости и транспортных средств, то ИНН присваивается налоговым органом, в который гражданин по своему выбору обратился с соответствующим заявлением (п. 7 ст. 83, п. 7 ст. 84 НК РФ; п. п. 9, 12 Приложения к Приказу N ММВ-7-6/435@).
Независимо от вашего желания вас поставят на учет в налоговом органе, если вы являетесь собственником недвижимого имущества или на ваше имя зарегистрировано транспортное средство (п. 2 ст. 84 НК РФ).
Например, если в собственности гражданина находится недвижимость или транспортное средство, то этот гражданин (в том числе несовершеннолетний ребенок) признается плательщиком налога на имущество физических лиц или транспортного налога. Это значит, что на него уже открыто учетное дело, и вполне возможно, что налоговые органы уже присвоили ему ИНН.
Это значит, что на него уже открыто учетное дело, и вполне возможно, что налоговые органы уже присвоили ему ИНН.
Узнать свой ИНН и дату вы можете, обратившись с паспортом в любой налоговый орган.
дата постановки на учет
Смотреть что такое «дата постановки на учет» в других словарях:
УЧЕТ НАЛОГОПЛАТЕЛЬЩИКОВ — система обязательных процедур постановки на учет, переучета и снятия с учета, присвоения идентификационного номера налогоплательщика, предусмотренных ст. 83 86 НК, осуществляемых в целях проведения налогового контроля. Налогоплательщики подлежат… … Энциклопедия российского и международного налогообложения
ЕДИНЫЙ ГОСУДАРСТВЕННЫЙ РЕЕСТР ИНДИВИДУАЛЬНЫХ ПРЕДПРИНИМАТЕЛЕЙ — согласно Федеральному закону «О государственной регистрации юридических лиц и индивидуальных предпринимателей» от 08.08.2001 № 129 ФЗ, содержит следующие сведения об индивидуальном предпринимателе: а) фамилия, имя и (в случае, если имеется)… … Делопроизводство и архивное дело в терминах и определениях
Единый государственный реестр юридических лиц — (ЕГРЮЛ) федеральный информационный ресурс, содержащий общие систематизированные сведения о юридических лицах, осуществляющих предпринимательскую деятельность на территории Российской Федерации.
 Ведение реестра осуществляется Федеральной… … Википедия
Ведение реестра осуществляется Федеральной… … ВикипедияЕДИНЫЙ ГОСУДАРСТВЕННЫЙ РЕЕСТР ЮРИДИЧЕСКИХ ЛИЦ — согласно Федеральному закону «О государственной регистрации юридических лиц и индивидуальных предпринимателей» от 08.08.2001 № 129 ФЗ, содержит следующие сведения и документы о юридическом лице: а) полное и (в случае, если имеется) сокращенное… … Делопроизводство и архивное дело в терминах и определениях
Сведения, содержащиеся в ЕГРЮЛ — В ЕГРЮЛ содержатся следующие сведения о юридическом лице: – наименование (полное и, если есть, сокращенное, в том числе фирменное). В случае если в учредительных документах организации ее название указано на иностранном языке, то в госреестре… … Банковская энциклопедия
Памятники архитектуры (Дюссельдорф-Бенрат) — Перечень памятников архитектуры Бенрата (административный район г. Дюссельдорфа, Германия) включает в себя 68 охраняемых законом и каталогизированных памятников архитектуры,представ … Википедия
Лицевой счет — (Client account) Содержание Содержание Определения описываемого предмета Банковский Лицевой счет налогоплательщика Правила ведения лицевых счетов Ведение лицевых счетов.
 Порядок открытия лицевых счетов Порядок ведения лицевых счетов исчисленных… … Энциклопедия инвестора
Порядок открытия лицевых счетов Порядок ведения лицевых счетов исчисленных… … Энциклопедия инвестораЛицевый счет — (Client account) Содержание Содержание Определения описываемого предмета Банковский Лицевой счет налогоплательщика Правила ведения лицевых счетов Ведение лицевых счетов. Порядок открытия лицевых счетов Порядок ведения лицевых счетов Учет… … Энциклопедия инвестора
Акт выездной налоговой проверки — в акте налоговой проверки должны быть указаны документально подтвержденные факты налоговых правонарушений, выявленные в ходе проверки, или отсутствие таковых, а также выводы и предложения проверяющих по устранению выявленных нарушений и ссылки на … Энциклопедический словарь-справочник руководителя предприятия
Правила усыновления (удочерения) детей в России — Минобрнауки предлагает ввести обязательную подготовку желающих принять на воспитание в свою семью ребенка, оставшегося без попечения родителей. Президиум правительства на заседании рассмотрит предложение.
 Усыновление (удочерение) детей –… … Энциклопедия ньюсмейкеров
Усыновление (удочерение) детей –… … Энциклопедия ньюсмейкеровПравила усыновления детей в России для россиян — Усыновление (удочерение) детей – один из институтов семейного права, юридический акт, в силу которого между усыновленным ребенком и его усыновителем устанавливаются правовые (личные и имущественные) отношения, аналогичные отношениям между… … Энциклопедия ньюсмейкеров
Что такое ИНН, ОГРН, КПП?
При создании юридического лица или регистрации физического лица в качестве индивидуального предпринимателя мы сталкиваемся с такими понятиями как ОГРН, ОГРНИП, ИНН, КПП. Что это? И как расшифровывается?
ОГРН и ОГРНИП
Это уникальный основной государственный регистрационный номер юридического лица или индивидуального предпринимателя в ЕГРЮЛ (Едином государственном реестре юридических лиц). ОГРН и ОГРНИП налоговые органы стали всем присваивать с июня 2002 года на основании Постановления Правительства РФ «О Едином государственном реестре юридических лиц» №438 от 19 июня 2002 г.
Реестр является открытым, то есть любое лицо вправе обратиться в регистрирующий орган с запросом о предоставлении сведений из государственного реестра по любой компании или по любому предпринимателю, зарегистрированным в пределах того региона, который обслуживает данный регистрирующий орган.
ОГРН состоит из 13 цифр, ОГРНИП— из 15.
В них содержится следующая информация:
1 цифра — признак отнесения государственного регистрационного номера записи (к основному государственному регистрационному номеру (ОГРН) — 1, 5; к иному государственному регистрационному номеру записи (внесение изменений) — 2; к основному государственному регистрационному номеру индивидуального предпринимателя (ОГРНИП) — 3)
4, 5 цифра — порядковый номер субъекта Российской Федерации по перечню субъектов Российской Федерации, установленному статьей 65 Конституции Российской Федерации
6 и 7 цифра — код номера межрайонной налоговой инспекции, выдавшей ОГРН юридическому лицу или ОГРНИП индивидуальному предпринимателю
с 8 по 12 (ОГРН) цифру и с 8 по 14 (ОГРНИП) цифру — номер записи, внесенной в государственный реестр в течение года
13 цифра (ОГРН) — контрольное число: остаток от деления предыдущего 12-значного числа на 11, если остаток от деления равен 10, то контрольное число равно 0 (нулю)
15 цифра (ОГРНИП) — контрольная цифра равна последней цифре остатка от деления предыдущего 14-значного числа на 13, а не на 11.
Пример расшифровки ОГРН:
На примере ОГРН 1117746358608 рассмотрим все сведение, которые можем получить из данной цифровой комбинации:
1 цифра – 1. Отвечает за отнесение записи по основному государственному регистрационному номеру.
2 и 3 цифра – 11. Это 2011 год – время, когда была осуществлена запись в государственный реестр.
4 и 5 цифра – 77. Это порядковый номер субъекта Российской Федерации – Москва, то есть именно в этом субъекте было зарегистрировано данное предприятие.
6 и 7 цифра – 46. Этот код отвечает непосредственно за определение филиала самой налоговой инспекции – МИ ФНС РФ № 46.
8 — 12 цифры – 35860. Эти цифры указывают на номер записи, которая была внесена в государственный реестр в течение года.
13 цифра – 8. Расчетное контрольное число.
Пример расшифровки ОГРНИП:
Возьмем за пример ОГРНИП 304500116000157, из данного номера можно плучить следующую информацию:
1 цифра – 3. Отвечает за отнесение записи по основному государственному регистрационному номеру.
2 и 3 цифра – 04. Это 2004год – время, когда была осуществлена запись в государственный реестр.
4 и 5 цифра – 50. Это порядковый номер субъекта Российской Федерации – Московская область, то есть именно в этом субъекте было зарегистрировано данное предприятие.
6 и 7 цифра – 01. Этот код отвечает непосредственно за определение филиала самой налоговой инспекции — ИФНС по г. Балашихе.
8 — 14 цифры – 1600015. Эти цифры указывают на номер записи, которая была внесена в государственный реестр в течение года.
15 цифра – 7. Расчетное контрольное число.
ИНН
Это уникальный идентификационный номер налогоплательщика. Присваивается как юридическим, так и физическим лицам. Организациям присваивается с 1993 года, индивидуальным предпринимателям — с 1997 года, прочим физическим лицам — с 1999 года.
Разница в количестве цифр кода— у физических лиц 12 цифр, у юридических лиц 10.
В ИНН содержится следующая информация:
1 — 4 цифра — код налогового органа, присвоившего ИНН согласно Справочнику налоговых органов (СОУН)
5 — 10 цифра (для физ. лиц) и с 5 по 9 цифру (для юр. лиц) — порядковый номер записи о налогоплательщике
лиц) и с 5 по 9 цифру (для юр. лиц) — порядковый номер записи о налогоплательщике
11 и 12 цифра (для физ. лиц) и 10 цифра (для юр. лиц) — контрольное число, рассчитываемое по специальному алгоритму, установленному Министерством Российской Федерации по налогам и сборам.
Пример расшифровки ИНН:
Допустим ИНН 500100732259, согласно данным цифрам получаем следующую информацию:
1 — 4 цифры – 5001. Это код налогового органа, присвоившего ИНН – ИФНС по г. Балашихе.
5 — 10 цифры – 007322. Это порядковый номер записи о налогоплательщике.
11 — 12 цифры – 59. Это контрольное число, рассчитываемое по специальному алгоритму, установленному Министерством Российской Федерации по налогам и сборам.
КПП
Код причины постановки на учет в налоговых органах. Присваивается вместе с ИНН только организациям, ИП и физическим лица не присваивается.
Код КПП состоит из девяти цифр и содержит согласно Приказу МНС России от 03.03.2004 N БГ-3-09/178 в ред. от 03.03.2004 № БГ-3-09/178 следующую информацию:
от 03.03.2004 № БГ-3-09/178 следующую информацию:
1 — 4 цифры — код налогового органа, где была поставлена на учет организация;
5 и 6 цифры — указывают на причину постановки на учет организации;
7 — 9 цифры — обозначают порядковый номер постановки на учет в налоговом органе.
КПП указано в свидетельстве вместе с ИНН организации. КПП обязательно проставляется в декларациях, платежных документах, расчетах во внебюджетные фонды. Поскольку у ИП нет КПП, то соответствующие графы для них остаются пустыми.
Пример расшифровки КПП:
За пример возьмем КПП 773301001 исходя из данных, получаем:
1 — 4 цифры – 7733. Это код налогового органа, где была поставлена на учет организация – ИФНС № 33 по г. Москве.
5 и 6 цифры – 01. Это код причины постановки на учет организации — постановка на учёт в налоговом органе российской организации в качестве налогоплательщика по месту ее нахождения.
7 по 9 цифры – 001. Это порядковый номер постановки на учет в налоговом органе.
КПП не содержит контрольного числа.
>Что такое КПП?
Код причины постановки на учет (КПП) — это код, который дополняет ИНН и содержит информацию об основании постановки на учет в налоговом органе.
Как расшифровать КПП?
Быстрое заведение первички, автоматическое заполнение ИНН и КПП контрагентов, бесплатные обновления и техподдержка.
Получить бесплатный доступ на 14 дней
КПП представляет собой последовательность из 9 арабских цифр.
- Первые два знака соответствуют коду субъекта Российской Федерации. У межрегиональных инспекций по крупнейшим налогоплательщикам первые две цифры в КПП — 99.
- Третий и четвертый знаки показывают номер налоговой инспекции, которая поставила на учет организацию или обособленное подразделение по месту их регистрации, местонахождению недвижимости или транспорта или обработала другие сведения, связанные с постановкой на учет или снятием с учета.
- Два знака в пятой и шестой позиции КПП указывают причину постановки на учет.
 Это могут быть не только цифры, но и заглавные буквы латинского алфавита от A до Z.
Это могут быть не только цифры, но и заглавные буквы латинского алфавита от A до Z.
Код с номером 001 означает, что российская организация встала на учет как налогоплательщик в налоговом органе по месту своего нахождения.
Коды 006 — 008 означают, что российская организация-налогоплательщик встала на учет по месту регистрации своего недвижимого имущества (в зависимости от вида имущества).
- Последние три знака — порядковый номер, который дается компании при постановке на учет в налоговом органе и по соответствующему основанию.
У многих компаний КПП совпадает. Это значит, что они зарегистрированы в одной налоговой инспекции по одинаковым основаниям.
КПП в паре с ИНН позволяет однозначно определить не только организацию, но и каждое ее обособленное подразделение.
Быстрое заведение первички, автоматическое заполнение ИНН и КПП контрагентов, бесплатные обновления и техподдержка.
Получить бесплатный доступ на 14 дней
Что нужно знать про КПП?
- У кредитных организаций КПП часто не указывается в документах.

- У индивидуальных предпринимателей КПП нет.
ИФНС и банки об этом знают и не требуют заполнять КПП, но между контрагентами иногда возникает непонимание. В этом случае нужно ссылаться на порядок регистрации индивидуальных предпринимателей и Налоговый кодекс.
- Крупнейшим налогоплательщикам присваивается дополнительный по месту постановки на учёт в качестве крупнейшего налогоплательщика.
Первые цифры этого КПП — 99, они показывают, что компания стоит на учете в межрегиональной инспекции по крупнейшим налогоплательщикам.
КПП крупнейшего налогоплательщика указывается в документах, связанных с расчетами по налогам федерального уровня.
НДС — федеральный налог, поэтому в счетах-фактурах указывается КПП крупнейшего налогоплательщика. Если в счете-фактуре указан КПП по месту нахождения организации, это не будет ошибкой и не препятствует получению вычета у контрагента.
КПП по месту нахождения организации указывается в документах, связанных с другими платежами в бюджет и прочими расчетами.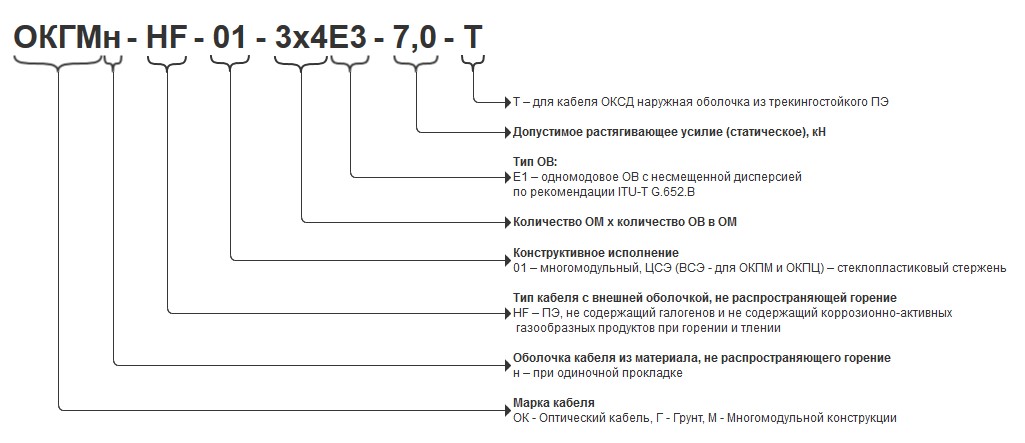
КПП: когда присваивается и что означает
Статья из журнала «ГЛАВНАЯ КНИГА» актуальна на 23 сентября 2011 г.
Содержание журнала № 19 за 2011 г.На вопросы отвечала В.А. Полянская, экономист
Налоговики постоянно требуют от нас проявлять осмотрительность при выборе поставщиков, и именно бухгалтеры вынуждены тщательно проверять все документы и обращать внимание на всевозможные реквизиты. Мы давно уже привыкли к этим аббревиатурам — ИНН и КПП. И кажется, что вопросов здесь никаких возникнуть не может. Между тем если об ИНН многие имеют представление и в курсе, где его проверить, то, кроме того, как расшифровывается КПП, о нем, как правило, больше никто ничего не знает. Вот какие вопросы нам задают.
КПП поможет определить, с кем вы имеете дело: с организацией или с ее филиалом
Е.Н. Дорофеева, г. Оренбург
У всех наших контрагентов КПП заканчивается на 01001. Но недавно, заполняя платежку, обнаружила у нового поставщика какой-то странный КПП — последние цифры 43001. Как понять, что это значит?
Как понять, что это значит?
: Такой КПП означает, что вы перечисляете деньги филиалу вашего контрагентаПисьмо ФНС России от 02.06.2008 № ЧД-6-6/396@.
КПП представляет собой 9-значный цифровой кодп. 1 Порядка и условий присвоения, применения, а также изменения идентификационного номера налогоплательщика… утв. Приказом МНС России от 03.03.2004 № БГ-3-09/178 (далее — Порядок).
1ст. 65 Конституции РФ
Например, КПП 770601001 означает, что организация находится в Москве и ИФНС России № 6 по г. Москве поставила ее на учет в качестве налогоплательщика по месту нахождения (код 01).
Если же 5-я и 6-я цифры КПП (ZZ) не 01 (например, как у вашего контрагента — 43), то это означает, что организацию поставили на учет по другим основаниям.
Полный перечень кодов причин постановки на учет приведен в ведомственном справочнике (СППУНО)утв. 11.10.99. Но этот справочник является внутренним документом. И если ранее он был выложен для всеобщего обозрения на официальном сайте ФНС, то сейчас найти его в свободном доступе проблематично. Но что означают некоторые коды, мы расскажем.
Но что означают некоторые коды, мы расскажем.
и можно попробовать получить расшифровку КПП — узнать регион и инспекцию, поставившую на учет вашего контрагента, причину постановки на учет. Но эта информация является неофициальной.
| Код | Причина постановки на учет |
| 02*, 03*, 43 | Регистрация филиала российской организации |
| 04*, 05*, 44 | Регистрация представительства российской организации |
| 31*, 32*, 45 | Сообщение об открытии обособленного подразделения российской организации |
* Данные коды сейчас не присваиваютсяПисьмо ФНС России от 02.06.2008 № ЧД-6-6/396@. Но КПП с этими кодами, присвоенные ранее, остаются действительными.
КПП может изменяться
А.Л. Зимина, г. Москва
У нашего контрагента изменился КПП. ОГРН и ИНН остались прежними. Что это означает? Переезд? Или могут быть еще варианты?
: У организации может появиться новый КПП, в частностип. 2.1.4 Порядка:
2.1.4 Порядка:
- при изменении места нахождения организации (переезде), когда приходится вставать на учет в другой налоговой инспекции;
- при постановке на учет по месту нахождения обособленных подразделений;
- при постановке на учет по месту нахождения недвижимого имущества и (или) транспортных средств;
- по иным основаниям, предусмотренным НК РФ. Например, при постановке на учет по месту нахождения участка недр (присваивается организациям, признанным налогоплательщиками налога на добычу полезных ископаемых)ст. 335 НК РФ.
Чаще всего КПП меняется, если организация переезжает и ей приходится вставать на учет в другой налоговой инспекциип. 2.1.4 Порядка; подп. «в» п. 1, п. 5 ст. 5 Федерального закона от 08.08.2001 № 129-ФЗ «О государственной регистрации юридических лиц и индивидуальных предпринимателей». Например, если КПП раньше был 7707 01001, а потом стал 7719 01001, это значит, что ваш контрагент состоял на учете в ИФНС № 7 по г. Москве, а теперь — в ИФНС № 19 по г. Москве.
Москве.
Если же в КПП изменились другие цифры, например код причины постановки, то лучше уточните у своего контрагента, правильный ли он.
КПП у разных организаций может быть одинаковый
В.С. Терентьева, г. Москва
У трех наших контрагентов одинаковый КПП. С ними что-то не так? Или такое возможно?
: Да, возможно. В отличие от ИНН (уникального номера, который единожды присваивается организации в момент регистрации и не изменяетсяп. 7 ст. 84 НК РФ; п. 3.1 Порядка), КПП определяет принадлежность организации к тому или иному налоговому органу, а также причину постановки на учет. Поэтому он может быть одинаковый у организаций, зарегистрированных в одной налоговой инспекции по одинаковым основаниямп. 1 Порядка.
Филиал, выставляя счет-фактуру, указывает в ней свой КПП
А.Т. Селиверстова, г. Екатеринбург
Мы купили товар у филиала нашего контрагента. Он выставил нам счет-фактуру от имени головной организации, а КПП указал свой (филиальный). Правильно ли это? Могут ли нам отказать в вычете, если указан неправильный КПП?
Правильно ли это? Могут ли нам отказать в вычете, если указан неправильный КПП?
: Ваш контрагент все сделал правильно. Контролирующие органы считают, что при реализации товаров через обособленные подразделения счет-фактура должен выставляться от имени головной организации, то есть в строках 2, 2а, 2б должны быть указаны наименование, ИНН, местонахождение самой организации, а в строках 2б и 3 — КПП и адрес обособленного подразделения (филиала)Письма Минфина России от 23.05.2011 № 03-07-09/12, от 01.04.2009 № 03-07-09/15, от 22.10.2008 № 03-07-09/33; Письмо УФНС России по г. Москве от 07.07.2010 № 16-15/071188.
Что касается вычета НДС, то ранее налоговики достаточно часто отказывали в нем при отсутствии КПП или его неправильном указании, но суды никогда их не поддерживалиПостановления ФАС МО от 17.12.2008 № КА-А40/11795-08; ФАС СЗО от 23.10.2008 № А56-39361/2007; ФАС СКО от 04.06.2008 № Ф08-3055/2008, от 28.10.2008 № Ф08-6493/2008. А после того как в НК РФ внесли поправкип. 2 ст. 169 НК РФ, в соответствии с которыми ошибки в счетах-фактурах, не препятствующие идентификации продавца, не являются основанием для отказа в вычете, проблем быть вообще не должно. Ведь КПП такой идентификации никак не мешает.
Предпринимателям КПП не присваивается
Т.В. Макарова, г. Самара
Наш покупатель, предприниматель, прислал нам реквизиты, где указан КПП, и заявил, что код действительно у него есть, но документ, подтверждающий это, он найти не может. Разве у индивидуальных предпринимателей есть КПП?
: Нет, КПП не присваивается предпринимателям. Он присваивается только юридическим лицамп. 1 Порядка; формы № 1-1-Учет, № 2-3-Учет, утв. Приказом ФНС России от 01.12.2006 № САЭ-3-09/826@.
При оформлении платежного поручения, в котором получателем платежа выступает предприниматель, поле «КПП (103)» не заполняетсяп. 2.10 Положения о безналичных расчетах в Российской Федерации, утв. Банком России 03.10.2002 № 2-П. Однако если ваш банк просит заполнить этот реквизит, то можно указать 0.
Крупнейшим налогоплательщикам присваивается дополнительный КПП
А.Г. Ефимова, г. Москва
Мы заметили, что в счетах-фактурах, выставляемых нашим контрагентом, изменился КПП — раньше он начинался на 7701, а теперь на 9971. Но адрес он указывает тот же, что и раньше. Что это может означать? Не будет ли у нас из-за этого проблем с вычетом входного НДС по таким счетам-фактурам?
: Новый КПП означает, что ваш контрагент приобрел статус крупнейшего налогоплательщика. А таких налогоплательщиков ставят на учет в одной из Межрегиональных инспекций по крупнейшим налогоплательщикам и присваивают им дополнительный КППп. 1 ст. 83 НК РФ; Приказ Минфина России от 11.07.2005 № 85н; п. 5 Критериев… утв. Приказом ФНС России от 16.05.2007 № ММ-3-06/308@. Таким образом, у них появляются два КПП: по месту постановки на учет в качестве крупнейшего налогоплательщика и по месту нахождения.
Межрегиональные инспекции по крупнейшим налогоплательщикам имеют код, в котором первые две цифры — 99, а следующие две цифры означают номер инспекции (например, 9971, как в вашем случае, — Межрегиональная инспекция ФНС по крупнейшим налогоплательщикам № 1, 9972 — Межрегиональная инспекция ФНС по крупнейшим налогоплательщикам № 2 и т. д.)Классификатор «Система обозначений налоговых органов» (СОНО).
Минфин рекомендует в счетах-фактурах указывать КПП, присвоенный налогоплательщику в качестве крупнейшего. Правда, если ваш поставщик укажет в документах КПП, присвоенный ему по месту нахождения, то это не будет считаться нарушениемПисьмо Минфина России от 14.05.2007 № 03-01-10/4-96. И проблем с вычетом НДС у вас все равно быть не должноп. 2 ст. 169 НК РФ.
Код причины постановки на учет (КПП)
Код причины постановки на учет (КПП) представляет собой девятизначный код, который налоговая инспекция присваивает организации при постановке на налоговый учет.
КПП необходим потому, что некоторые фирмы состоят на учете в нескольких налоговых инспекциях: не только по своему юридическому адресу, но и по месту нахождения обособленных подразделений, недвижимости и налогооблагаемых транспортных средств.
Так как ИНН у всех должен быть один, то налоговые органы ввели дополнительный код – КПП.
Этот код показывает, по какой причине фирма состоит на учете в данной инспекции.
У одной фирмы может быть несколько КПП.
Код причины постановки на учет присваивается по каждому основанию постановки на учет, в том числе по месту нахождения самой организации, ее обособленных подразделений (ОП), земельных участков и иной недвижимости, транспорта.
В отличие от ИНН, Код причины постановки на учет организации может меняться.
Так, если организация сменит адрес на другой адрес, который относится к другой налоговой инспекции, компании присвоят новый КПП.
Значение КПП можно узнать из свидетельства или уведомления о постановке на учет.
КПП организации по месту ее нахождения также указан в едином государственном реестре юридических лиц (ЕГРЮЛ).
Первые четыре цифры КПП представляют собой код налогового органа, в котором организация поставлена на учет.
Из них первые две цифры представляют собой код региона, а третья и четвертая цифры являются кодом (номером) налоговой инспекции.
Например, КПП, начинающийся на 7713, означает, что организация состоит на учете в ИФНС N 13 по г. Москве.
Пятая и шестая цифры КПП указывают причину постановки на учет.
Например:
цифры 01 означают, что КПП присвоен организации в связи с постановкой на учет по месту ее нахождения;
цифры 02, 03, 04, 05, 31 или 32 означают, что КПП присвоен организации по месту нахождения обособленного подразделения организации;
цифры 06-08 означают, что КПП присвоен организации по месту нахождения принадлежащего ей недвижимого имущества (таким образом, транспортные средства не затрагиваются) в в зависимости от вида имущества;
цифры 10-29 – означают, что КПП присвоен организации по месту нахождения принадлежащих ей транспортных средств в зависимости от вида транспортных средств;
цифры 50 означают, что КПП присвоен в связи с постановкой на учет в качестве крупнейшего налогоплательщика.
Последние три цифры КПП представляют собой порядковый номер постановки организации на учет в ИФНС по основанию, в связи с которым ей присвоен этот КПП.
Организации должны указывать ИНН и КПП во всех документах, предназначенных для налоговых инспекций.
Так, КПП организации следует указывать:
во всех налоговых декларациях и расчетах;
в платежных поручениях, в том числе в платежных поручениях на уплату налогов и страховых взносов;
в счетах-фактурах и других документах, где обязательно указание КПП.
Так как у организации может быть несколько КПП, то в документе указывается код, присвоенный в налоговой инспекции, который предназначен для данного документа.
КПП организации. Где его найти и как использовать — Блог Dadata.ru
Зачем налоговая выдает КППВ ФНС придумали КПП, чтобы идентифицировать организации. Обычно для этого используют ИНН. Но его не хватает, если компания встает на учет в несколько налоговых инспекций.
Например, банк из Москвы открывает филиал в Череповце. У головной организации и филиала будет одинаковый ИНН. При этом они встают на учет в разные инспекции: по Москве и по Череповцу. Чтобы различать непосредственно банк и филиал, ФНС присваивает им отдельные КПП. Теперь налоговый инспектор понимает, чья декларация перед ним лежит, а контрагенты — с кем работают.
Или компания из Москвы купила недвижимость в Калуге. Тогда юрлицо встает на учет в две налоговые инспекции по разным причинам: в Москве — по месту регистрации, в Калуге — по месту нахождения недвижимости. ФНС выдает компании два КПП.
КПП иногда меняют.
Организация сменила место регистрации с Москвы на Череповец. Тогда налоговая выдает компании новый КПП, а старый отбирает.
ИП не получают КПП, потому что встают на учет в налоговую по единственной причине — месту регистрации. Кодировать нечего.
Что означают цифры в КПП организацииКПП состоит из девяти цифр. Это шифр.
Первая и вторая цифры — код региона или области РФ, где компания стоит на учете.
Третья и четвертая — номер налоговой инспекции, в которой числится организация или ее подразделение.
Пятая и шестая — причина учета. Например, по месту регистрации юрлица, по месту нахождения недвижимости или транспортных средств, по месту нахождения филиала. Причины лежат в справочнике причин постановки на учет налогоплательщиков-организаций в налоговых органах.
Последние три цифры — количество постановок организации на учет по указанной причине.
Организация впервые встает на учет по месту регистрации и получает КПП ******001. Затем меняет место регистрации и получает новый КПП ******002 вместо первого — это вторая регистрация по той же причине. А если встанет на учет еще и по месту нахождения недвижимости, то получит второй КПП ******001.
Расшифровка КПП ООО «Дейта Кью» — владельца «Дадаты»Разным компаниям выдают одинаковые КПП, если они встали на учет в одну инспекцию по одной и той же причине равное число раз.
У компании, которая впервые встала на учет по месту регистрации в ИФНС №4 по Москве, будет такой же КПП, как у «Дадаты» — 770401001.
Поэтому КПП смотрят в паре с ИНН, чтобы не перепутать организации.
Бухгалтеры, которые умеют расшифровывать КПП, оформляют документы без ошибок.
Подготавливая декларацию в налоговую, специалист не перепутает КПП казанского и саратовского филиалов. Их легко отличить по первым двум цифрам — коду региона.
Зачем нужен КППНекоторые причины учета — пятая и шестая цифры в КПП — сигнализируют о добросовестности контрагента.
****50*** — компанию поставили на учет как крупнейшего налогоплательщика РФ. Как «РЖД», «Аэрофлот», «Билайн», «Роснефть» и т. п. С такими ребятами безопасно работать.
****17*** — компанию поставили на учет по месту нахождения автомобильных транспортных средств, число которых на территории одного налогового органа превышает 999. Если у организации хватает денег на столько автомобилей, она вряд ли окажется однодневкой.
Логика такая — ненадежный контрагент вряд ли закупит много недвижимости и автомобилей.
По региону — первым двум цифрам в КПП — выделяют контрагентов, которых стоит проверить дополнительно.
У компании большие убытки по дебиторской задолженности в Кабардино-Балкарии — для нее это рисковый регион. Тогда контрагентов с КПП 07******* проверяют усерднее.
КПП указывают в документах, касающихся налогов и страховых взносов, чтобы придать юридическую силу.
Собственный КПП организации указывают:
- в декларациях;
- расчетах;
- справках о доходах по форме 2-НДФЛ.
Собственный КПП и КПП получателя — налоговой инспекции или отделения ФСЗН — указывают в платежных поручениях:
- на уплату налогов,
- сборов,
- страховых взносов,
- пеней,
- штрафов.
Если деньги переводят контрагенту, указывать КПП не нужно.
КПП в платежном поручении на уплату налога на прибыльСобственный КПП и КПП покупателя указывают:
- в счетах-фактурах,
- книгах продаж и покупок,
- журналах учета полученных и выставленных счетов-фактур.
КПП организации находят в выписке из ЕГРЮЛ, указав ИНН или название юрлица:
«Дадата» найдет КПП по ИНН, чтобы быстро подготовить документы
Получать КПП контрагента удобно через API-метод «Организация по ИНН» «Дадаты». Сервис находит КПП и головной организации, и филиалов. Наши пользователи получают реквизиты по API и автоматически подставляют в документы. Так бухгалтер не будет копаться в выписке ЕГРЮЛ или вызванивать контрагента, чтобы подготовить счет-фактуру. Вместе с КПП «Дадата» покажет еще 200 строк информации о контрагентеесть или нет, что обозначают цифры, зачем нужен, как узнать по ИНН
Индивидуальный предприниматель, как и юридические лица, при постановке на налоговый учет получают разные идентификационные номера, например ИНН, ОГРНИП и другие. Сложности вызывает КПП. Все дело в том, что не совсем ясно, присваивается ли он частному бизнесмену, ведущему деятельность без открытия организации или нет.
Назначение и структура кодаНа основании дешифровки можно сформулировать определение понятия. КПП – это опознавательный номер предприятия, который присваивается на этапе его регистрации в налоговой инспекции и означает причину занесения компании в реестр.
Как правило, КПП необходим для установлении категории налогоплательщика. Его указывают при составлении налоговой отчетности, при совершении банковских переводов на расчетный счет, при заключении контрактов, соглашений, а также при открытии личного счета организации, предназначенного для расчетов.
Внешне КПП выглядит как группа чисел. Всего насчитывается 9 символов. Больше или меньше знаков код содержать не может. Условно его можно обозначить в следующем виде: «ССССППННН».
Чтобы понять, что означает каждое из чисел, необходимо подробно ознакомиться со структурой КПП.
| Количество знаков | Обозначение | Что означает |
| Первые 4 символа | СССС | Номер территориального подразделения налоговой службы, которая зарегистрировала компанию.. |
| Следующие 2 знака | ПП | Основания для регистрации фирмы в ФНС. |
| Последние 3 символа | ННН | Личный номер налогоплательщика, который не повторяется. |
Таким образом, по КПП можно определить, где именно компания осуществляет деятельность, а также на каких основаниях ее зарегистрировали в ФНС.
Где найти КПП и кому он присваиваетсяКПП можно в таких документах организации, как в налоговой отчетности, заключенных с контрагентами договорах, в платежных и иных бумагах.
Он присваивается исключительно организациям, то есть юридическим лицам. Индивидуальные предприниматели не имеют КПП, поэтому данный код не отражается при составлении ни одного документа.
Зачастую случается так, что партнер, несмотря на объяснения предпринимателя, настаивает на указание в соглашении КПП. Тогда нужно постараться указать на тот факт, что на основании действующего законодательства, а точнее приказа ФНС, частным бизнесменам, не желающим зарегистрировать компанию, данный код не присваивается, а в качестве идентификации налогоплательщика можно использовать ИНН.
Как правило, КПП присваивается ЮЛ в территориальном подразделении налоговой инспекции в следующих случаях:
- первичная регистрация фирмы в ФНС;
- повторная регистрация организации, например в случае смены юридического адреса;
- на налоговый учет становится структурное подразделение фирмы;
- регистрируется место, где находится имущество предприятия.
КПП у ИП: есть или нет?Важно! КПП присваивается не только российским юридическим лицам, но и иностранным фирмам, которые планируют вести деятельность на территории РФ и уплачивать налоги в России.
Ни один российский предприниматель, зарегистрированный в частном виде, не имеет КПП. Код просто-напросто не присваивается бизнесменам, которые ведут деятельность без образования юридического лица.
Идентифицировать компанию физического лица, осуществляющего работу по привлечению денежных средств путем реализации собственной идеи можно по ИНН. Именно данный идентификационный номер указывается в платежных документах, отчетности, а также при открытии расчетного счета.
Важно! Запрещено указывать вместо КПП ИНН. Место, где отражает код причины постановки на учет, оставляют пустым. Для ИНН предусмотрено соответствующее поле.
Если при составлении документации предприниматель допускает подобную ошибку, то есть указывает вместо КПП ИНН, то правовые последствия такой бумаги могут быть признаны недействительными, а сам документ ничтожным.
Вместо КПП у ИПКак уже было сказано ранее, индивидуальным предпринимателям КПП не присваивается. Вместо него ИП использует ИНН.
По общим правилам ИНН присваивается индивидуальному предпринимателю единожды, еще до регистрации частного бизнеса. То есть, идентификационный номер устанавливается при первом обращении гражданина за свидетельством о его присвоении физическому лицу.
Что такое ИНН?ИНН присваивается как юридическим, так и физическим лицам, в том числе индивидуальным предпринимателям. Как правило, данный номер никогда не повторяется и является уникальным. При помощи него налоговая служба идентифицирует конкретного гражданина, его частное дело или компанию.
Надо отметить, что ИНН физического лица отличается от номера организации на 2 цифры. Если идентификатор граждан и ИП состоит из числовой комбинации в 12 знаков, то ИНН организации включает в себя 10 символов.
Как узнать ИНН у ИПВажно! ИНН физического лица никогда не меняется, даже в том случае, если россиянин открывает индивидуальное предприятие.
ИНН физического лица или индивидуального предпринимателя находится в свободном доступе. Его можно найти, не выходя из дома. Достаточно иметь любой гаджет с выходом в интернет.
Для того чтобы определить идентификационный номер ИП, необходимо знать фамилию, имя, отчество бизнесмена или наименование самого частного предприятия. Как правило, ИП называется по имени предпринимателя, например, компания Иванова А.А. будет названа, как «ИП Иванов А.А.»
Услугу по открытию информации о некоторых сведениях ИП предоставляет Федеральная налоговая служба в рамках программы «Прозрачный бизнес».
Если же начинающий предприниматель еще не успел зарегистрироваться в налоговой, а его компания не внесена в реестр, то узнать его ИНН можно, если известны данные гражданского или заграничного паспорта, свидетельства о рождении, либо другого идентификатора личности.
Если ИП сам не может определить свой ИНН, то он имеет право запросить подобную информацию через личный кабинет на официальном сайте налоговой инспекции, либо через портал Госуслуги.
Важно! Утратив свидетельство о присвоении индивидуального номера налогоплательщика, предпринимателю требуется незамедлительно обратиться в территориальное подразделение ФНС России для получения дубликата.
Надо отметить, что сам идентификационный номер никогда не меняется. Однако при смене фамилии, имени, отчества частного лица, требуется заменить свидетельство.
Структура ИНН у ИПИНН у ИП можно расшифровать. Главное – знать, что означает каждая из группы чисел. Как уже было сказано ранее, номер ИП и физического лица состоит из 12 знаков. Само выражение поделено на 4 комбинации.
- Первая группа, которая состоит из двух чисел, стоящих впереди, означает в каком регионе выдано свидетельство. То есть, в каком территориальном подразделении ИП поставлен на налоговый учет.
- Следующие два символа обозначают конкретное подразделение налоговой инспекции, которое выдало свидетельство. Как правило, данная пара одинакова для всех налогоплательщиков, которые зарегистрированы в одном и том же территориальном подразделении ФНС.
- Следующая числовая комбинация, состоящая из 6 знаков, представляет собой номер, идентифицирующий конкретного налогоплательщика.
- Заключительные два числа определяются налоговой инспекцией при помощи специальной формулы. Они указывают на достоверность указанной в свидетельстве информации, а также исключают подделку данного документа.
Таким образом, индивидуальному предпринимателю вместо КПП присваивается индивидуальный номер налогоплательщика. Это связано с тем, что нет необходимости устанавливать причины постановки на налоговый учет физического лица.
ИП и физическое лицо: налоговый номерИНН гражданина и индивидуального предпринимателя – это совершенно идентичный номер. То есть идентификатор гражданина не меняется даже в том случае, если человек решил заняться предпринимательской деятельностью.
Все дело в том, что ИП – это такое же физическое лицо. В связи с этим менять номер налогоплательщика нет необходимости.
Таким образом, получив свидетельство о присвоении индивидуального налогового номера, в случае регистрации частного бизнеса, сама числовая комбинация останется прежней.
Как узнать КПП по ИННУзнать КПП по ИНН можно путем запроса выписки из единого реестра. Ведомство предоставит основную информацию о компании в течение 10 рабочих суток после направления запроса без оплаты государственной пошлины.
Как правило, КПП юридического лица прописывается в свидетельство о регистрации. Через дробь отражается ИНН компании.
КПП можно найти на официальном портале, разработанном ФНС России, который называется «Прозрачный бизнес». Для получения данной информации достаточно знать, как именуется предприятие или его ИНН.
Отличие КПП от ИННГлавное отличие КПП от ИНН заключается в том, что данный номер может меняться, а ИНН присваивается один раз в жизни.
КПП присваивается только юридическим лицам. Он может быть разный для структурных подразделений одной фирмы.
Интересно, но КПП иногда повторяется. То есть, идентичным номером может обладать не одна компания, а сразу несколько. Все дело в том, что КПП указывает, в каком территориальном подразделении ведомства зарегистрировано предприятие, основания постановки на учет, а также порядковый номер.
В отличие от КПП ИНН никогда не повторяется. Схожими могут быть лишь некоторые группы чисел, которые обозначают, в каком регионе и каким конкретным территориальным подразделением выдано свидетельство. 6 числе посредине комбинации – это уникальное выражение, которое не повторяется в разрезе региона.
Что такое ОГРН индивидуального предпринимателя?
Каждое лицо, открывающее индивидуальное дело, должно зарегистрироваться в государственном реестре налоговой инспекции и получить уникальный код, называемый основным государственным регистрационным номером (ОГРН). Необходимость этого обусловлена, прежде всего, наличием вышестоящего контролирующего органа, необходимого для быстрого поиска и чтения информации.
История ОГРН
С распадом СССР все формы собственности, организации и ведения бизнеса пришлось переоформлять, то есть приватизировать.В период реструктуризации стали появляться акционерные общества, для функционирования которых было достаточно иметь идентификационный номер налоговой инспекции. Такая система взаимоотношений государства и частного сектора оставляла желать лучшего: во-первых, предприятия несли убытки от дополнительных затрат на аудит и бухгалтерский учет; Во-вторых, вмешательство государства во внутренние дела компаний и организаций привело к стагнации рынка свободной конкуренции. После долгого хаоса экономическая система стремилась к гармонии.Таким образом, появились определенные механизмы регулирования, которые, с одной стороны, упростили делопроизводство предприятий, а с другой — сделали налоговую отчетность более прозрачной. С развитием рынка и появлением дополнительных форм собственности органами государственного контроля ввели в действие ОГРН индивидуального предпринимателя, в функции которой входит оперативный поиск базовой информации о любом предприятии и индивидуальном бизнесе страны.
Основные термины и условные обозначения
Итак, ОГРН ИП — государственный регистрационный номер, включающий в себя всю информацию, необходимую контролирующим и надзорным органам для выполнения своих функций.Этот номер присваивается один раз и не может быть изменен в течение всего существования бизнеса. Проверить ОГРН ИП можно в налоговой инспекции. Там он внесен в Единый государственный реестр индивидуальных предпринимателей, сокращенно ЕГРИП. Также важно знать о государственном регистрационном номере (НГР), который меняется в соответствии с изменениями в реестре. Это делается, например, при получении предпринимателем нового паспорта.
Назначение ОГРН ИП
Государство автоматизировало и упростило задачу проверки и контроля ИП, присвоив им ОГРН, который содержит всю основную информацию об их деятельности.Поиск Индивидуального оператора ОГРН покажет форму собственности, год основания, место регистрации, ссылку на конкретную налоговую инспекцию и другую информацию. При этом ИНН (индивидуальный налоговый номер) предоставит вам информацию только о территориальном положении субъекта. Проверить ОГРН индивидуального предпринимателя можно на сайте ФНС, также это указывается в справках, выдаваемых налоговыми органами.
Разъяснение к ОГРН
В пятидневный срок со дня подачи заявления в налоговую службу выдает субъекту свидетельство о постановке на учет индивидуального предпринимателя.В нем указывается вид деятельности, название предприятия, а также сам ОГРН. Он состоит из пятнадцати знаков, каждый из которых имеет свое значение: C_ГГ_КК_НН_ХХХХХХХ_Ч.
- Первая буква — это номер штата.
- «ГГ» означает год регистрации предприятия (например, 2015 будет обозначен как 15).
- «КК» — символы, обозначающие регионы субъектов России (77, например, город Москва).
- NN — наименование налоговой инспекции, дающей реквизиты.
- С восьмого по четырнадцатый знак — индивидуальный номер лица, получившего ОГРН.
- Последний знак «Ч» — математическая константа, полученная путем деления всех предыдущих четырнадцати цифр на 13.
Таким образом, ОГРН индивидуального предпринимателя в РФ появился для упрощения работы государственных органов по поиску лиц и их упорядочению. . Предпринимателю такая система взаимоотношений выгодна тем, что сокращается время бухгалтерской работы.
p>Сывороточный амилоид А связывается с фибрином (огеном), способствуя образованию фибринового амилоида.
Улар, К. М. и Уайтхед, А. С. Сывороточный амилоид А, основной реагент острой фазы позвоночных. Eur J Biochem 265 , 501–523 (1999).
CAS Статья Google ученый
Кутзи, Г. А. и др. . Липопротеин высокой плотности человека, содержащий амилоид А 3. Плотность, размер и состав аполипопротеинов. J Biol Chem 261 , 9644–9651 (1986).
CAS PubMed Google ученый
Эриксен, Н. и Бендитт, Э. П. Выделение и характеристика амилоид-родственного апопротеина (SAA) из липопротеинов высокой плотности человека. Proc Natl Acad Sci USA 77 , 6860–6864 (1980).
ADS CAS Статья Google ученый
Malle, E., Steinmetz, A. & Raynes, J. G. Сывороточный амилоид A (SAA): белок острой фазы и аполипопротеин. Атеросклероз 102 , 131–146 (1993).
CAS Статья Google ученый
де Бир, М. К. и др. . Влияние сывороточного амилоида А на состав и уровни липопротеинов высокой плотности. J Lipid Res 51 , 3117–3125, https://doi.org/10.1194/jlr.M005413 (2010).
CAS Статья PubMed PubMed Central Google ученый
Niemi, K. et al. . Сывороточный амилоид A активирует воспаление NLRP3 через рецептор P2X7 и путь, чувствительный к катепсину B. J Immunol 186 , 6119–6128, https://doi.org/10.4049/jimmunol.1002843 (2011).
CAS Статья PubMed Google ученый
Сонг, К. и др. . Амилоид А в сыворотке может усиливать протромботические и провоспалительные явления при острых коронарных синдромах. Атеросклероз 202 , 596–604, https://doi.org/10.1016/j.atherosclerosis.2008.04.049 (2009).
CAS Статья PubMed Google ученый
Vitale, A. et al. . Сывороточный амилоид-А при болезни Бехчета. Clin Rheumatol 33 , 1165–1167, https: // doi.org / 10.1007 / s10067-014-2555-9 (2014).
Артикул PubMed Google ученый
Келл, Д. Б. и Преториус, Е. Плохое поведение белков. Субстехиометрический молекулярный контроль и усиление инициации и природы образования амилоидных фибрилл: уроки свертывания крови и свертывания крови. Prog Biophys Mol Biol 123 , 16–41, https://doi.org/10.1016/j.pbiomolbio.2016.08.006 (2017).
CAS Статья PubMed Google ученый
Преториус, Э. и др. . И липополисахарид, и липотейхоевая кислота сильно индуцируют аномальное образование амилоида фибрина: оценка с помощью новых красителей Amytracker ™. Интерфейс Королевского общества 15 , 20170941, https://doi.org/10.1098/rsif.2017.0941 (2018).
CAS Статья Google ученый
Преториус, Э., Мботве, С., Бестер, Дж., Робинсон, К. Дж. И Келл, Д. Б. Острая индукция аномального и амилоидогенного свертывания крови путем молекулярной амплификации высоко субстехиометрических уровней бактериального липополисахарида. Journal of the Royal Society Interface 13 , https://doi.org/10.1098/rsif.2016.0539 (2016).
Стангу А. Дж. и др. . Наследственный фибриноген Амилоидоз с альфа-цепью: фенотипическая характеристика системного заболевания и роль трансплантации печени. Кровь 115 , 2998–3007, https://doi.org/10.1182/blood-2009-06-223792 (2010).
CAS Статья PubMed Google ученый
Литвинов Р. И., Файзуллин Д. А., Зуев Ю. Ф. и Вайзель Дж. У. Переход от альфа-спирали к бета-слою в растянутых и сжатых сгустках гидратированного фибрина. Biophys J 103 , 1020–1027, https://doi.org/10.1016/j.bpj.2012.07.046 (2012).
CAS Статья PubMed PubMed Central Google ученый
Лангкильде, А. Э., Моррис, К. Л., Серпелл, Л. К., Свергун, Д. И., Вестергаард, Б.Архитектура амилоидоподобных пептидных фибрилл, выявленная методами рассеяния рентгеновских лучей, дифракции и электронной микроскопии. Acta Crystallogr D Biol Crystallogr 71 , 882–895, https://doi.org/10.1107/s139
CAS Статья PubMed PubMed Central Google ученый
Габай К. и Кушнер И. Белки острой фазы и другие системные реакции на воспаление. N Engl J Med 340 , 448–454, https: // doi.org / 10.1056 / nejm199
CAS Статья PubMed Google ученый
Husebekk, A., Skogen, B., Husby, G. & Marhaug, G. Трансформация амилоидного предшественника SAA в белок AA и включение в амилоидные фибриллы in vivo . Scand J Immunol 21 , 283–287 (1985).
CAS Статья Google ученый
Вестермарк Г. Т., Фандрих М. и Вестермарк П. А. Аамилоидоз: патогенез и таргетная терапия. Анну Рев Патол 10 , 321–344, https://doi.org/10.1146/annurev-pathol-020712-163913 (2015).
CAS Статья PubMed Google ученый
Преториус, Э., дю Плоуа, Дж. Н. и Бестер, Дж. Всесторонний обзор эриптоза. Физиология и биохимия клетки 39 , 1977–2000, https: // doi.org / 10.1159 / 000447895 (2016).
CAS Статья Google ученый
Pretorius, E., Swanepoel, A.C., DeVilliers, S. & Bester, J. Параметры сгустка крови: тромбоэластография и сканирующая электронная микроскопия в исследованиях и клинической практике. Исследование тромбоза 154 , 59–63, https://doi.org/10.1016/j.thromres.2017.04.005 (2017).
CAS Статья PubMed Google ученый
Сома, П. и Преториус, Э. Взаимодействие между ультраструктурными данными и атеротромботическими осложнениями при сахарном диабете 2 типа. Cardiovasc Diabetol 14 , 96, https://doi.org/10.1186/s12933-015-0261-9 (2015).
Артикул PubMed PubMed Central Google ученый
Soma, P., Swanepoel, A.C, du Plooy, J. N., Mqoco, T. & Pretorius, E. Проточный цитометрический анализ тромбоцитов сахарного диабета 2 типа выявляет «сердитые» тромбоциты. Сердечно-сосудистая диабетология 15 , 52, https://doi.org/10.1186/s12933-016-0373-x (2016).
Артикул PubMed PubMed Central Google ученый
Ан, Х. Дж. и др. . Новый ингибитор взаимодействия абета-фибриноген устраняет измененный тромбоз и снижение когнитивных функций у мышей с болезнью Альцгеймера. J Exp Med 211 , 1049–1062, https://doi.org/10.1084/jem.20131751 (2014).
CAS Статья PubMed PubMed Central Google ученый
Ан, Х. Дж., Чен, З. Л., Замолодчиков, Д., Норрис, Э. Х. и Стрикленд, С. Взаимодействие бета-амилоидного пептида с фибриногеном и фактором свертывания крови XII может способствовать развитию болезни Альцгеймера. Curr Opin Hematol 24 , 427–431, https://doi.org/10.1097/moh.0000000000000368 (2017).
CAS Статья PubMed PubMed Central Google ученый
Замолодчиков Д. и др. . Биохимический и структурный анализ взаимодействия бета-амилоида и фибриногена. Кровь 128 , 1144–1151, https://doi.org/10.1182/blood-2016-03-705228 (2016).
CAS Статья PubMed PubMed Central Google ученый
Urieli-Shoval, S. et al. . Адгезия тромбоцитов человека к сывороточному амилоиду A. Кровь 99 , 1224–1229 (2002).
CAS Статья Google ученый
Zimlichman, S., Danon, A., Nathan, I., Mozes, G. & Shainkin-Kestenbaum, R. Сывороточный амилоид А, белок острой фазы, ингибирует активацию тромбоцитов. J Lab Clin Med 116 , 180–186 (1990).
CAS PubMed Google ученый
Pretorius, L. et al. . Активность тромбоцитов и гиперкоагуляция при диабете 2 типа. Cardiovasc Diabetol 17 , 141, https://doi.org/10.1186/s12933-018-0783-z (2018).
Артикул PubMed PubMed Central Google ученый
Джахангири А. и др. . Ремоделирование ЛПВП во время острой фазы ответа. Arterioscler Thromb Vasc Biol 29 , 261–267, https://doi.org/10.1161/atvbaha.108.178681 (2009).
CAS Статья PubMed Google ученый
Страчан, А.Ф. и др. . Белок амилоида А. сыворотки человека. Отнесение шести основных изоформ к трем опубликованным последовательностям генов и доказательство наличия двух генетических локусов. Журнал биологической химии 264 , 18368–18373 (1989).
CAS PubMed Google ученый
Zewinger, S. et al. . Сывороточный амилоид А: взаимодействие липопротеинов высокой плотности и сердечно-сосудистый риск. Европейский журнал сердца 36 , 3007–3016, https://doi.org/10.1093/eurheartj/ehv352 (2015).
CAS Статья PubMed Google ученый
Нильсен, В. Г., Кирклин, Х. К., Хугендорн, Х., Эллис, Т. К. и Холман, В. Л. Тромбоэластографический метод для количественной оценки вклада фактора XIII в кинетику свертывания. Свертывание крови и фибринолиз: международный журнал по гемостазу и тромбозам 18 , 145–150, https: // doi.org / 10.1097 / MBC.0b013e32802f7d91 (2007).
CAS Статья Google ученый
Нильсен, В. Г., Лайерли, Р. Т. и Герли, В. К. Влияние разбавления на кинетику свертывания плазмы, определенную с помощью тромбэластографии, зависит от активности антитромбина и способа активации. Анестезия и обезболивание 99 , 1587–1592, https://doi.org/10.1213/01.ANE.0000136843.58799.AB (2004).
CAS Статья PubMed Google ученый
Нильсен, В. Г. и Матика, Р. В. Влияние железа и окиси углерода на деградацию плазматической коагуляции, опосредованную ядом Lachesis muta muta. Hum Exp Toxicol , https://doi.org/10.1177/0960327116661401 (2016).
Артикул PubMed Google ученый
Бестер Дж. И Преториус Э. Влияние IL-1β, IL-6 и IL-8 на эритроциты, тромбоциты и вязкоупругость сгустка. Научные отчеты 6 , 32188, https: // doi.org / 10.1038 / srep32188 (2016).
ADS CAS Статья PubMed PubMed Central Google ученый
Сулатская, А.И., Лавыш, А.В., Маскевич, А.А., Кузнецова, И.М., Туроверов, К.К. Тиофлавин Т флуоресцирует в виде эксимера в высококонцентрированных водных растворах и в виде мономера, включаемого в амилоидные фибриллы. Sci Rep 7 , 2146, https://doi.org/10.1038/s41598-017-02237-7 (2017).
ADS CAS Статья PubMed PubMed Central Google ученый
Pretorius, E., Mbotwe, S. & Kell, D. B. Липополисахарид-связывающий белок (LBP) меняет амилоидное состояние фибрина, наблюдаемое в плазме плохо контролируемых диабетиков 2 типа с сопутствующими сердечно-сосудистыми заболеваниями. Scientific Reports (Nature) In Press (2017).
Goetz, J. G., Monduc, F., Schwab, Y. & Vermot, J.Использование корреляционной световой и электронной микроскопии для изучения морфогенеза сосудов у рыбок данио. Методы Mol Biol 1189 , 31–46, https://doi.org/10.1007/978-1-4939-1164-6_3 (2015).
Артикул PubMed Google ученый
Онучи Т., Шиогама К., Мизутани Ю., Такаки Т. и Цуцуми Ю. Визуализация внеклеточных ловушек нейтрофилов и фибриновой сетки при фибрино-гнойных воспалительных поражениях человека: III.Корреляционное световое и электронно-микроскопическое исследование. Acta Histochem Cytochem 49 , 141–147, https://doi.org/10.1267/ahc.16028 (2016).
CAS Статья PubMed PubMed Central Google ученый
López, C. S. et al. . Полностью интегрированный рабочий процесс корреляции трехмерной флуоресценции и электронной микроскопии. Методы Cell Biol 140 , 149–164, https: // doi.org / 10.1016 / bs.mcb.2017.03.008 (2017).
Артикул PubMed Google ученый
Пейдж, М. Дж., Бестер, Дж. И Преториус, Э. Интерлейкин-12 и его прокоагулянтное действие на эритроциты, тромбоциты и фибрин (ноген): менее известная сторона воспаления. Британский гематологический журнал , https://doi.org/10.1111/bjh.15020 (2017).
Бродхерст, Д. и Келл, Д. Б. Статистические стратегии для предотвращения ложных открытий в метаболомике и связанных с ней экспериментах. Метаболомика 2 , 171–196 (2006).
CAS Статья Google ученый
Чан, Ф. Т. и др. . Во время агрегации белковые амилоиды приобретают характерную флуоресцентную сигнатуру. Аналитик 138 , 2156–2162, https://doi.org/10.1039/c3an36798c (2013).
ADS CAS Статья PubMed PubMed Central Google ученый
Тихонова Т.Н. и др. . Рассечение темно-синих изменений автофлуоресценции, сопровождающих фибрилляцию амилоида. Arch Biochem Biophys 651 , 13–20, https://doi.org/10.1016/j.abb.2018.05.019 (2018).
CAS Статья PubMed Google ученый
Преториус, Э., Мботве, С. и Келл, Д. Б. Липополисахарид-связывающий белок (LBP) обращает вспять амилоидное состояние фибрина, наблюдаемое в плазме крови больных диабетом 2 типа с сопутствующими сердечно-сосудистыми заболеваниями. Sci Rep 7 , 9680, https://doi.org/10.1038/s41598-017-09860-4 (2017).
ADS Статья PubMed PubMed Central Google ученый
Преториус, Э., Пейдж, М. Дж., Энгельбрехт, Л., Эллис, Г. С. и Келл, Д. Б. Существенный амилоидогенез фибрина при диабете 2 типа оценивается с помощью амилоид-селективных флуоресцентных красителей. Cardiovasc Diabetol 16 , 141, https://doi.org/10.1186 / s12933-017-0624-5 (2017).
CAS Статья PubMed PubMed Central Google ученый
Преториус, Э., Бестер, Дж., Пейдж, М. Дж. И Келл, Д. Б. Потенциал LPS-связывающего белка для обратного образования амилоида в плазменном фибрине людей с деменцией альцгеймеровского типа. Front Aging Neurosci 10 , 257, https://doi.org/10.3389/fnagi.2018.00257 (2018).
Артикул PubMed PubMed Central Google ученый
Преториус, Э., Пейдж, М. Дж., Мботве, С. и Келл, Д. Б. Липополисахаридсвязывающий белок (LBP) может изменить амилоидное состояние фибрина, наблюдаемое или индуцируемое при болезни Паркинсона: последствия. PlosOne 13 , e01, https://doi.org/10.1371/journal.pone.01 (2018).
CAS Статья Google ученый
Вагнер Д. и Бургер П. С. Тромбоциты при воспалении и тромбозе. Arterioscler Thromb Vasc Biol 23 , 2131–2137, https: // doi.org / 10.1161 / 01.Atv.0000095974.95122.Ec (2003).
CAS Статья PubMed Google ученый
Нагаредди П. и Смит С. С. Воспаление и тромбоз при сердечно-сосудистых заболеваниях. Текущее мнение в гематологии 20 , 457–463, https://doi.org/10.1097/MOH.0b013e328364219d (2013).
CAS Статья PubMed PubMed Central Google ученый
van der Stoep, M., Korporaal, S.J. и Van Eck, M. Липопротеины высокой плотности как модулятор тромбоцитарных и коагуляционных реакций. Cardiovasc Res 103 , 362–371, https://doi.org/10.1093/cvr/cvu137 (2014).
CAS Статья PubMed Google ученый
Ан, Х. Дж. и др. . Бета-амилоид пептида болезни Альцгеймера взаимодействует с фибриногеном и вызывает его олигомеризацию. Proc Natl Acad Sci 107 , 21812–21817, https://doi.org/10.1073/pnas.1010373107 (2010).
ADS Статья PubMed Google ученый
Cortes-Canteli, M. et al. . Связь фибриногена и бета-амилоида изменяет тромбоз и фибринолиз: возможный фактор, способствующий развитию болезни Альцгеймера. Neuron 66 , 695–709, https://doi.org/10.1016/j.neuron.2010.05.014 (2010).
CAS Статья PubMed PubMed Central Google ученый
Zamolodchikov, D. & Strickland, S. Abeta задерживает лизис фибринового сгустка за счет изменения структуры фибрина и ослабления связывания плазминогена с фибрином. Кровь 119 , 3342–3351, https://doi.org/10.1182/blood-2011-11-389668 (2012).
CAS Статья PubMed PubMed Central Google ученый
Замолодчиков Д. и Стрикленд С. Возможная новая роль Abeta в сосудистой и воспалительной дисфункции при болезни Альцгеймера. Thromb Res 141 (Приложение 2), S59–61, https://doi.org/10.1016/s0049-3848(16)30367-x (2016).
CAS Статья PubMed Google ученый
Marx, G. et al. . Тепловая денатурация фибриногена для создания биомедицинской матрицы. J Biomed Mater Res B Appl Biomater 84 , 49–57, https: // doi.org / 10.1002 / jbm.b.30842 (2008 г.).
CAS Статья PubMed Google ученый
Kim, M.-H., de Beer, M.C., Wroblewski, J.M., Webb, N.R. & de Beer, F.C. SAA не индуцирует продукцию цитокинов в физиологических условиях. Cytokine 61 , 506–512, https://doi.org/10.1016/j.cyto.2012.10.019 (2013).
CAS Статья PubMed Google ученый
Миядзаки О., Огихара Дж., Фукамачи И. и Касуми Т. Доказательства присутствия в плазме мономолекулярного аполипопротеина А-1, не содержащего липидов. J Lipid Res 55 , 214–225, https://doi.org/10.1194/jlr.M041038 (2014).
CAS Статья PubMed PubMed Central Google ученый
Wilson, P.G. et al. . Сывороточный амилоид А — это обменный аполипопротеин. Arterioscler Thromb Vasc Biol 38 , 1890–1900, https: // doi.org / 10.1161 / atvbaha.118.310979 (2018).
CAS Статья PubMed Google ученый
de Beer, F. C. & Webb, N. R. Воспаление и атеросклероз: sPLA2 группы IIa и группы V не являются избыточными. Arterioscler Thromb Vasc Biol 26 , 1421–1422, https://doi.org/10.1161/01.ATV.0000227561.89488.9a (2006).
CAS Статья PubMed Google ученый
Джин, В., Миллар, Дж. С., Бродл, У., Глик, Дж. М. и Рейдер, Д. Дж. Ингибирование эндотелиальной липазы вызывает повышение уровня холестерина ЛПВП in vivo . Журнал клинических исследований 111 , 357–362, https://doi.org/10.1172/JCI16146 (2003).
CAS Статья PubMed PubMed Central Google ученый
Acton, S. et al. . Идентификация рецептора скавенджера SR-BI как рецептора липопротеинов высокой плотности. Наука 271 , 518–520 (1996).
ADS CAS Статья Google ученый
Ма, Ю., Ашраф, М. З. и Подрез, Э. А. Рецептор скавенджера BI модулирует реактивность тромбоцитов и тромбоз при дислипидемии. Кровь 116 , 1932–1941, https://doi.org/10.1182/blood-2010-02-268508 (2010).
CAS Статья PubMed PubMed Central Google ученый
Wroblewski, J. M. et al. . Образование новых ЛПВП гепатоцитами снижается за счет согласованного действия сывороточного амилоида А и эндотелиальной липазы. Журнал исследований липидов 52 , 2255–2261, https://doi.org/10.1194/jlr.M017681 (2011).
CAS Статья PubMed PubMed Central Google ученый
Отложение фибрина (огена) в печени стимулирует регенерацию печени после частичной гепатэктомии у мышей и людей | Кровь
Печень обладает уникальной регенеративной способностью.После резекции печени, при которой можно безопасно удалить до 70% ткани печени, остаток печени быстро восстанавливается до своего первоначального размера. 1 Успешная регенерация важна для функционирования остатка печени. Однако у некоторых пациентов регенерация печени недостаточна или вообще не начинается из-за плохо изученных механизмов. Фактически, неспособность регенерации часто встречается у пациентов с острой печеночной недостаточностью и у пациентов после обширной резекции печени. 2,3 Пострезекционная печеночная недостаточность остается одним из наиболее серьезных осложнений резекции печени и представляет собой значительный источник заболеваемости и смертности. 3 Несмотря на это, не существует эффективных вариантов лечения для улучшения регенерации печени у пациентов, перенесших резекцию печени. Пациентам, страдающим неудачной регенерацией, может потребоваться трансплантация печени или они могут умереть от печеночной недостаточности. 4 Лучшее понимание механизмов, участвующих в регенерации печени, может определить новые терапевтические цели для улучшения послеоперационной функции органов, что принесет пользу пациентам с печеночной недостаточностью, вызванной неудачной регенерацией.
Экспериментальные и клинические данные свидетельствуют о центральной роли тромбоцитов и факторов, производных от тромбоцитов, в регенерации остатка печени после частичной гепатэктомии. Тромбоциты быстро накапливаются в остатке печени после частичной гепатэктомии (PHx) у мышей 5 и резекции печени у людей, 6 , и регенерация печени значительно задерживается, когда тромбоциты истощены или функционально нарушены. 5,7 И наоборот, повышенное количество тромбоцитов, например, вызванное тромбопоэтином, стимулирует регенерацию печени после PHx. 5,8,9 У людей переливание тромбоцитов, по-видимому, улучшает регенерацию у живых доноров-реципиентов трансплантата 10 и функцию печени у пациентов с циррозом. 11 Низкое количество тромбоцитов, измеренное сразу после резекции печени, связано с дисфункцией печени и послеоперационной смертностью. 12,13 Используя более прямое измерение регенерации печени (объемная визуализация поперечного сечения), Margonis et al. 13 обнаружили, что относительное увеличение объема печени было значительно ниже у пациентов с низким количеством тромбоцитов.В совокупности эти исследования показывают, что тромбоциты играют ключевую роль в стимуляции регенерации печени. Один предложенный механизм, посредством которого тромбоциты стимулируют регенерацию печени, связан с секрецией факторов роста активированными тромбоцитами в микрососудистом русле печени. 6,14 Однако сообщалось также о других механизмах, посредством которых тромбоциты могут стимулировать регенерацию, включая перенос РНК от тромбоцитов к гепатоцитам и опосредованное тромбоцитами рекрутирование воспалительных клеток (обзор в другом месте Lisman and Luyendyk 15 ).Таким образом, точный механизм (ы), посредством которых тромбоциты накапливаются и способствуют регенерации печени, остается неясным.
Тромбоциты могут активироваться несколькими триггерами, включая тромбин, что приводит к активации рецептора тромбоцитов α IIb β 3 . Связывание фибриногена и фибрина, конечного продукта каскада коагуляции, с α IIb β 3 опосредует взаимодействия тромбоцитов, приводящие к агрегации тромбоцитов. 16 Активированные тромбоциты могут усиливать коагуляцию за счет воздействия на прокоагулянтную поверхность, которая способствует образованию тромбина, и за счет выведения белков свертывания, таких как фибриноген. 17 Недавно Beier et al. 18 задокументировали отложения фибрина (огена) в печени после PHx у мышей и сообщили, что ингибирование тромбина снижает внутрипеченочные отложения фибрина (огена) и пролиферацию гепатоцитов после PHx. Хотя внутрипеченочное отложение фибрина (оген) было снижено ингибитором тромбина гирудином, фибрин (оген) не был окончательно идентифицирован как мишень тромбина, управляющая регенерацией.Более того, механизмы, ответственные за повышение активности тромбина после PHx, неизвестны, и в настоящее время неясно, играет ли фибрин (оген) прямую роль в регенерации печени после PHx. Мы стремились определить механизм, управляющий отложением фибрина (огена) в остатке печени после PHx, и определить, вносят ли фибрин (оген) и «перекрестное взаимодействие тромбоцитов и коагуляции» вклад в регенерацию печени после PHx.
Соответствующие возрастные группы мышей в возрасте от 11 до 17 недель подверглись частичной резекции печени на две трети в соответствии с опубликованными протоколами с некоторыми изменениями. 21,22 Вкратце, PHx выполняли у голодных мышей во время светового цикла путем резекции левой боковой доли, правой части средней доли и левой части средней доли с использованием 3 отдельных лигатур. Этот метод сохраняет желчный пузырь, чтобы предотвратить закупорку внепеченочного желчного дерева. Имитационные операции включали мягкие манипуляции с долями печени без удаления ткани печени. Хирургические процедуры выполнялись под глубокой хирургической анестезией, индуцированной изофлураном (Abbott, Чикаго, Иллинойс).Перед операцией мышам вводили подкожно 5 мг / кг карпрофена (Rimadyl; Pfizer, New York, NY) для обезболивания. Для исследований истощения фибриногена вводили 2,5 ед. Анкрода на мышь (Национальный институт биологических стандартов и контроля, Саут-Миммс, Великобритания) или носитель (стерильный физиологический раствор) путем подкожной инъекции за 2 часа до или через 2 часа после PHx. Для исследований истощения тромбоцитов крысиным моноклональным антителом, направленным против мышиного гликопротеина Ibα (GPIbα; 4 мкг / г веса тела; R300, Emfret Analytics, Вюрцбург, Германия) или носителя (стерильный физиологический раствор) вводили путем внутривенной инъекции за 24 часа до операции.Истощение тромбоцитов подтверждали измерением количества тромбоцитов до и через 24 часа после инъекции у 4 мышей. Образцы крови и печени собирали либо через 30 минут, либо через 3 дня после PHx или ложной операции. Кровь собирали под глубокой хирургической анестезией путем обескровливания из нижней полой вены сразу после инъекции 150 мкл 3,4% цитрата натрия (Merck, Дармштадт, Германия), разведенного в физиологическом растворе в селезенке. Образцы крови центрифугировали при 1400 g в течение 10 минут (без тормоза) для получения плазмы и хранили при -80 ° C.Уровни тромбина-антитромбина (ТАТ) в плазме определяли с использованием имеющегося в продаже набора для иммуноферментного анализа (Siemens Health Care Diagnostics, Deerfield, IL). Печень промывали физиологическим раствором и фиксировали либо 4% формальдегидом, либо мгновенно замораживали в жидком азоте для иммуногистохимических анализов.
Уровни фибриногена в плазме оценивали у пациентов, перенесших резекцию печени в Венском медицинском университете (Вена, Австрия).Всего было включено 312 пациентов, перенесших резекцию печени в период с 2001 по 2014 год. Измерения проводили в цитратной крови, взятой перед резекцией печени, а также в первый и пятый послеоперационные сутки (POD) по методу Клаусса. 23,24 Кроме того, у 11 пациентов были взяты образцы биопсии печени как в начале операции (до), так и из регенерирующей доли печени через 2 часа после перевязки воротной вены (после резекции). После операции пациенты наблюдались в течение 90 дней, и послеоперационный результат был проспективно задокументирован.В частности, дисфункция печени (LD) была определена в соответствии с критериями Международной исследовательской группы хирургии печени. Вкратце, пациенты с уровнем билирубина> 1,2 мг / дл и протромбиновым временем <70% на POD 5 были классифицированы как пациенты с LD. 25 В случаях аномального уровня билирубина или протромбинового времени перед операцией пациенты должны были показать ухудшение обоих параметров в течение 2 дней подряд после POD 5, чтобы считаться положительными для LD в соответствии с критериями Международной исследовательской группы хирургии печени.Кроме того, пациенты с нормальными значениями сывороточного билирубина или протромбинового времени до POD 5 были выписаны раньше из-за хороших клинических показателей и, следовательно, не имели дальнейшего сбора крови и, следовательно, не считались LD. Послеоперационная смертность определялась как смерть в течение 90 дней после операции. 26 Исследование было одобрено этическим комитетом Венского медицинского университета, и все пациенты дали письменное информированное согласие.
срезов печени мышей окрашивали на Ki-67 в исследовательской гистопатологической лаборатории Университета штата Мичиган.Вкратце, срезы инкубировали в течение 10 минут с готовым к использованию Background Punisher (BioCare Medical, Pacheco, CA) для уменьшения неспецифического фонового окрашивания. Затем слайды инкубировали с поликлональным кроличьим антителом против Ki-67 мыши (конечная концентрация 1,5 мкг / мл; MilliporeSigma, Burlington, MA) в течение 30 минут при комнатной температуре. Затем срезы инкубировали с готовым к использованию HRP-полимером кролика на грызунах (BioCare Medical) в течение 1 часа с последующей инкубацией с хромогеном Romulin AEC (BioCare Medical) в течение 5 минут.В выборочных исследованиях срезы окрашивали на Ki-67, как описано ранее. 27 Степень отложения фибрина (огена) оценивали на парафиновых срезах печени мыши и человека, как описано в другом месте. 28 Вкратце, фиксированные ацетоном срезы инкубировали с Avidin / Biotin Blocking Kit (Dako, Glostrup, Дания). Затем срезы инкубировали с поликлональным кроличьим антителом против фибриногена человека (1: 750, A0080; Dako) в течение 1 часа при комнатной температуре. После промывки срезы инкубировали с биотинилированным козьим антикроличьим иммуноглобулином G (1: 100, BA-1000; Vector Labs, Brunschwig, Burlingame, CA) в течение 45 минут.После промывания срезы инкубировали с реагентом Vectastain ABC-AP (SK-5100 Vector Red, Vector Labs) в течение 30 минут, промывали и инкубировали в течение 20 минут с реагентом щелочной фосфатазы Vector Red (AK-5000; Vector Labs). Все срезы контрастировали гематоксилином, закрепляли глицериновым желатином Kaiser и сканировали с использованием цифрового сканера слайдов Nano-Zoomer (Hamamatsu Photonics K.K., Хамамацу, Япония). Ki-67-положительные гепатоциты подсчитывали по крайней мере в 5 полях с высоким увеличением на мышь с помощью программного обеспечения ImageJ (версия 1.51 Вт; National Institutes of Health, Bethesda, MD) и выражается в процентах от всех гепатоцитов.
Количественную оценку отложений фибрина выполняли с помощью программного обеспечения ImageJ. Для анализа случайным образом были выбраны пять мощных полей для каждой ткани. Площадь положительного окрашивания фибрина (оген) на каждом изображении определялась беспристрастным образом с использованием пакетного макроса и инструмента деконволюции цвета в ImageJ. Положительный сигнал выражали как количество положительных пикселей.Кроме того, для печени человека процент положительного окрашивания фибрина также выражали как кратное изменение по сравнению со значениями образца биопсии печени, взятого перед операцией. Накопление тромбоцитов у живых мышей оценивали вскоре после PHx прижизненной микроскопией, как описано ранее. 27,29 Вкратце, тромбоциты метили in vivo непосредственно перед визуализацией путем внутривенной инъекции 1,6 мкг конъюгированного с фикоэритрином хомячка антимышиного CD49b (клон HMα2; BioLegend, San Diego, CA).Получение изображения начинали в течение 5 минут после PHx и выполняли в течение 1 часа с использованием инвертированного микроскопа Zeiss LSM 780 NLO (Axio Observer.Z1; Carl Zeiss, Оберкохен, Германия). Изображения получали с использованием аргонового лазера 488 нм и спектрального детектора на основе фосфида арсенида галлия при длине волны от 508 до 561 нм для автофлуоресцентного обнаружения печени и при 569-655 нм для обнаружения фикоэритрина. Анализ агрегатов тромбоцитов выполняли, как описано ранее. 27
Поскольку мы не наблюдали увеличения внутрипеченочного отложения фибрина (огена) у пациентов, страдающих послеоперационной ЛД, мы оценили, связаны ли уровни фибриногена в плазме с плохим восстановлением функции печени после резекции печени.Образцы крови были взяты у 312 пациентов за 1 день до операции и на POD 1 и POD 5. Из 312 включенных пациентов у 32 (10%) развился пострезекционный LD. Предоперационные уровни фибриногена в плазме не различались между пациентами, независимо от того, страдали ли они от ЛД после резекции (421 ± 102 мг / дл против 429 ± 91 мг / дл) (рис. 5А). Однако пациенты, которые страдали от послеоперационного LD, имели значительно более низкие уровни фибриногена в плазме на POD 1 по сравнению с пациентами, которые этого не делали (349 ± 82 мг / дл против 272 ± 73 мг / дл).Эта разница в уровнях фибриногена в плазме также наблюдалась на POD 5 (565 ± 147 мг / дл против 376 ± 182 мг / дл). Мы также оценили, были ли уровни фибриногена в плазме связаны с послеоперационной смертностью, определяемой как смерть в течение 90 дней после операции. Предоперационные уровни фибриногена в плазме не различались между умершими и выжившими пациентами (421 ± 97 мг / дл против 419 ± 158 мг / дл) (рис. 5B). Однако у пациентов с послеоперационной смертностью уровни фибриногена в плазме были значительно ниже как на POD 1 (343 ± 83 мг / дл против 267 ± 73 мг / дл), так и на POD 5 (548 ± 160 мг / дл против 363 ± 192 мг / дл. ) по сравнению с пациентами, не страдающими послеоперационной летальностью.
Рисунок 5.
Низкие послеоперационные уровни фибриногена в плазме связаны с LD и смертностью у пациентов, перенесших резекцию печени. Уровни фибриногена в плазме были измерены за 1 день до резекции (PRE OP) и на POD 1 и POD 5 у 312 пациентов. (A) Уровни фибриногена в плазме у пациентов, у которых (пурпурные прямоугольные диаграммы, n = 32) или нет (голубые прямоугольные диаграммы, n = 280) развился LD после резекции.(B) Уровни фибриногена в плазме у пациентов, которые имели (желто-зеленые прямоугольные диаграммы, n = 8) или не страдали (горчичные диаграммы, n = 304) послеоперационной смертностью в течение 90 дней после резекции. Анализ рабочих характеристик приемника уровней фибриногена в плазме на (C) POD 1 и (D) POD 5 для прогнозирования послеоперационной дисфункции печени. (E) Частота заболеваемости, послеоперационного LD и смертности в соответствии с определенным пороговым значением для уровней фибриногена в плазме на POD 1 (300 мг / дл). На панелях A и B показаны коробчатые диаграммы со средним значением, межквартильным размахом от 25% до 75%, а также минимальным и максимальным уровнями фибриногена.Панель E показывает частоту (в процентах) заболеваемости, LD и смертности. * P <.05. AUC, площадь под кривой.
Рисунок 5.
Низкие послеоперационные уровни фибриногена в плазме связаны с LD и смертностью у пациентов, перенесших резекцию печени. Уровни фибриногена в плазме были измерены за 1 день до резекции (PRE OP) и на POD 1 и POD 5 у 312 пациентов. (A) Уровни фибриногена в плазме у пациентов, у которых (пурпурные прямоугольные диаграммы, n = 32) или нет (голубые прямоугольные диаграммы, n = 280) развился LD после резекции.(B) Уровни фибриногена в плазме у пациентов, которые имели (желто-зеленые прямоугольные диаграммы, n = 8) или не страдали (горчичные диаграммы, n = 304) послеоперационной смертностью в течение 90 дней после резекции. Анализ рабочих характеристик приемника уровней фибриногена в плазме на (C) POD 1 и (D) POD 5 для прогнозирования послеоперационной дисфункции печени. (E) Частота заболеваемости, послеоперационного LD и смертности в соответствии с определенным пороговым значением для уровней фибриногена в плазме на POD 1 (300 мг / дл). На панелях A и B показаны коробчатые диаграммы со средним значением, межквартильным размахом от 25% до 75%, а также минимальным и максимальным уровнями фибриногена.Панель E показывает частоту (в процентах) заболеваемости, LD и смертности. * P <.05. AUC, площадь под кривой.
Мы также стремились охарактеризовать потенциал послеоперационных уровней фибриногена в плазме для прогнозирования послеоперационных клинических исходов. Анализ рабочей характеристической кривой приемника выявил значительную связь между послеоперационными уровнями фибриногена плазмы и LD на обоих POD 1 (площадь под кривой, 0.757) (рис. 5C) и POD 5 (площадь под кривой, 0,808) (рис. 5D). Поскольку раннее прогнозирование послеоперационного LD имеет решающее значение для принятия клинических решений, пороговый уровень для уровня фибриногена в плазме на POD 1 был определен с использованием статистики Юдена J. Действительно, пациенты с уровнями фибриногена в плазме ниже порогового значения 300 мг / дл на POD 1 (рис. 5E) демонстрировали более высокую заболеваемость (48,3% против 32,7%), послеоперационную LD (24,7% против 4,8%) и смертность в пределах 90%. дней после операции (5,6% против 1.4%).
Ранее было замечено, что низкое количество тромбоцитов является независимым предиктором отсроченного послеоперационного восстановления функции печени и связано с повышенным риском послеоперационной смертности после резекции печени у людей. 12 У мышей регенерация печени также значительно задерживается, когда тромбоциты истощены или функционально нарушены. 5,7 В рамках настоящего исследования мы окончательно определили внутрипеченочное отложение фибрина (огена) как центральную молекулу для раннего внутрипеченочного накопления тромбоцитов, стимулирующего регенерацию печени после PHx.Предыдущие исследования также показали, что другие гемостатические факторы, включая фактор фон Виллебранда (VWF), способствовали внутрипеченочному накоплению и регенерации тромбоцитов после PHx. 27,31 Действительно, мы обнаружили, что раннее и избирательное удаление отдельных компонентов гемостаза (т. Е. Тромбоцитов, TF, VWF, 27 фибрина (оген)) аналогичным образом задерживает регенерацию печени после резекции печени. Следует отметить, что взаимные взаимодействия между этими различными факторами (например, тромбоциты способствуют коагуляции и наоборот) затрудняют идентификацию строго линейного механизма, посредством которого эти медиаторы способствуют регенерации.Тем не менее, это сложное взаимодействие подчеркивает важность системы гемостаза в регенерации печени, что отражается в том факте, что дефицит любого из этих гемостатических компонентов может иметь глубокое негативное влияние на регенерацию печени после PHx.
Отложения фибрина (огена) недавно наблюдались в печени мышей после PHx, 18 , но механизм, запускающий отложение внутрипеченочного фибрина (огена), был неизвестен.Мы обнаружили, что связанный с печенью TF запускает быстрый внутрипеченочный прокоагулянтный ответ (то есть в течение 30 минут) после PHx. В результате типичного повреждения сосудов субэндотелиальный ТФ подвергается действию своего лигандного фактора VIIa (FVIIa), запускающего коагуляцию. 32 Однако в печени гепатоциты экспрессируют комплекс TF: FVIIa в зашифрованной форме, который обладает минимальной прокоагулянтной активностью или не имеет ее и требует активации посредством расшифровки для активации коагуляции. 19 Триггеры активации ТФ гепатоцитов после PHx неизвестны.Среди основных стимулов для активации TF — потеря асимметрии фосфолипидов на внешней клеточной мембране и взаимодействие комплекса TF: FVIIa с внешним фосфатидилсерином. В моделях острого и хронического повреждения печени апоптотическая гибель клеток является одним из потенциальных триггеров экстернализации и коагуляции фосфатидилсерина 33-35 ; однако гибель клеток минимальна после PHx из-за сильной активации антиапоптотического пути Akt. 36 Тем не менее, это открытие не исключает неапоптотических механизмов экстернализации фосфатидилсерина как движущей силы коагуляции после PHx.Активация коагуляции может также происходить как следствие гемодинамических изменений в остатке печени. Действительно, повышенное напряжение внутрипеченочного сдвига было предложено в качестве стартового сигнала для регенерации, и было показано, что оно увеличивает экспрессию и активность TF в других экспериментальных условиях. 37,38 Хотя механизм, посредством которого печеночный TF активируется после PHx, неизвестен, наши исследования являются первыми, кто идентифицирует печеночный TF как ранний и критический триггер регенерации печени, опосредованной коагуляцией.
Предыдущее исследование показало, что ингибирование активности тромбина задерживает регенерацию печени у мышей после PHx, предполагая потенциальную роль фибрина (огена) в регенерации печени. 18 Более того, отсутствие ингибитора активатора плазминогена-1, который увеличивает отложение фибрина (огена) в печени, улучшает регенерацию после PHx. Хотя оба этих исследования косвенно затрагивали фибрин (оген), ни одно из них не идентифицировало фибрин (оген) как прорегенеративный стимул после PHx.Здесь мы впервые показываем, что фибрин (оген) непосредственно способствует регенерации печени после PHx у мышей. Примечательно, что быстрое внутрипеченочное отложение фибрина (огена) имеет решающее значение для поддержки более поздних событий регенерации, что проявляется в снижении пролиферации гепатоцитов у мышей, у которых фибриноген истощался до PHx. Напротив, истощение фибриногена через 2 часа после PHx не влияло на более позднюю пролиферацию гепатоцитов. Поразительно, но это наблюдение можно было также применить в клинических условиях резекции печени, где отсутствие внутрипеченочного отложения фибрина (огена) в регенерирующей печени было напрямую связано с развитием послеоперационной ЛД.Кроме того, мы обнаружили, что низкие послеоперационные уровни фибриногена в плазме были связаны с LD и смертностью после резекции печени у людей и что уровни фибриногена в плазме на POD 1 могут предсказывать плохой послеоперационный исход у пациентов, перенесших резекцию. Взятые вместе, параллели между экспериментальными данными и подтверждением на людях в отношении отложения фибрина (огена) подчеркивают его значимость во время регенеративных процессов после резекции печени. Причина неудачного отложения фибрина (огена) в печени у некоторых пациентов не известна, но может быть следствием снижения потенциала образования тромбина во время регенерации печени или неудачи расшифровки ТФ в печени.В будущих исследованиях следует рассмотреть откалиброванный автоматический тест на образование тромбина или маркеры активации коагуляции, такие как протромбиновый фрагмент 1 + 2, для определения относительного состояния гипокоагуляции и измерения образования тромбина у пациентов, подвергающихся резекции. Однако количество тромбина, генерируемого в печени, может быть слишком маленьким, чтобы вызвать заметное увеличение протромбинового фрагмента 1 + 2 в системном кровотоке, и существуют явные проблемы при измерении расшифровки печеночного ТФ у пациентов.
Предыдущее исследование показало, что тромбин способствует регенерации после PHx. 18 Наши исследования показали, что механизм, посредством которого тромбин запускает регенерацию печени, не опосредован активацией тромбоцитов, поскольку пролиферация гепатоцитов не пострадала у мышей PAR-4 — / — после PHx. Хотя активация тромбоцитов тромбином не требуется для регенерации, дополнительные пути активации тромбоцитов могут объяснить стимулирующее действие тромбоцитов на регенерацию печени.Действительно, у мышей, которым вводили ингибитор P2Y12 клопидогрел, нарушалась регенерация печени после PHx. 7 Здесь мы впервые документируем, что внутрипеченочное отложение фибрина (огена), вызванное тромбином, стимулирует регенерацию печени. Наши результаты показывают, что фибрин (оген) поддерживает локализацию и агрегацию тромбоцитов в печени после PHx, поскольку выведение фибриногена у мышей снижает накопление внутрипеченочных тромбоцитов. Действительно, известно, что фибрин (оген) непосредственно управляет агрегацией тромбоцитов, связываясь с интегрином α IIb β 3 на тромбоцитах. 16 Внутрипеченочное отложение фибрина (огена) может, таким образом, напрямую стимулировать регенерацию, действуя как матрица для локализации и стимулирования агрегации тромбоцитов в печени после PHx. Действительно, в небольшом исследовании мы обнаружили, что накопление тромбоцитов после PHx резко снижается у мышей, лишенных интегрина α IIb (CD41) на своих тромбоцитах (дополнительный рисунок 1A-C, доступный на веб-сайте Blood ). Однако возможно, что внутрипеченочный фибрин (оген) также способствует привлечению и активации других типов клеток, необходимых для регенерации печени, в дополнение к рекрутированию тромбоцитов.Например, включение фибрином (оген) интегрина α M β 2 является катализатором управляемого лейкоцитами восстановления печени после передозировки ацетаминофена. 39 Лейкоциты рекрутируются в остаток печени у мышей, перенесших PHx, а регенерация печени задерживается у мышей с лейкоцитопенией. 40 Таким образом, вполне возможно, что взаимодействия фибрин (оген) с лейкоцитами способствуют регенерации после PHx, как при токсическом поражении печени. 39 В качестве альтернативы, фибрин (оген) может потребоваться для стимулирования лейкоцит-направленного рекрутирования тромбоцитов или наоборот, после PHx.Хотя взаимодействие между тромбоцитами и лейкоцитами в условиях PHx широко не изучалось, в других моделях тромбоциты образуют поверхность для адгезии лейкоцитов, и взаимодействие между этими двумя типами клеток может способствовать восстановлению печени. 41
Крупные резекции печени становятся все более безопасными благодаря совершенствованию оперативных методов. Тем не менее, у значительного числа пациентов наблюдается нарушение регенерации печени. 4 Этот результат представляет особый интерес, поскольку в настоящее время нет доступных стратегий для стимуляции регенерации печени. Важно отметить, что гемостатическая система может предлагать биомаркеры, способные предсказывать успешную регенерацию у пациентов, и обеспечивать новые предполагаемые терапевтические цели для восстановления регенерации после резекции печени у людей. Например, некоторые клинические данные свидетельствуют о том, что введение концентратов тромбоцитов улучшает исход после операции на печени у людей. 10,11 Однако повышенный риск тромбоза (воротной вены), смертность 42 , 43 и рецидив рака 44 создают высокое соотношение риск / польза.В этом контексте было показано, что начальный всплеск уровней VWF в плазме важен для адекватного накопления тромбоцитов и регенерации печени у пациентов, перенесших резекцию печени. 31 Следовательно, инфузия 1-дезамино-8-d-аргинина вазопрессина (DDAVP), препарата, стимулирующего секрецию VWF, или добавки VWF кажутся привлекательной альтернативой концентратам тромбоцитов. Однако DDAVP, скорее всего, будет эффективен только у пациентов с относительно низкими исходными уровнями VWF, 31,45 и добавление VWF может увеличить риск тромбоза. 46-48 Наши экспериментальные и клинические данные показывают, что внутрипеченочное отложение фибрина (огена) непосредственно после регенерации печени необходимо для поддержки регенерации печени. Таким образом, добавление концентрата фибриногена до или во время процедуры резекции может быть новым клиническим подходом для нацеливания на неэффективные регенеративные реакции с гораздо лучшим соотношением риск / польза, чем добавление тромбоцитов или VWF. Тромбогенный потенциал концентратов фибриногена кажется низким, 49 , и было показано, что добавление фибриногена безопасно в контексте трансплантации печени. 50 Основываясь на наших экспериментальных и клинических данных, необходимы дополнительные исследования, изучающие прорегенеративные эффекты фибриногена в экспериментальных условиях, поскольку эти исследования могут привести к новым стратегиям улучшения регенерации печени.
В заключение мы определили быстрое внутрипеченочное отложение фибрина (огена) как процесс, управляемый печеночным TF, в остатке печени после PHx у мышей. Это исследование является первым, кто окончательно идентифицирует отложение фибрина (огена) как прямой стимул для регенерации печени после PHx.Кроме того, наши данные подчеркивают важность этого процесса для послеоперационной регенерации печени человека. Результаты показывают, что пути регенерации печени, стимулируемые коагуляцией и тромбоцитами, тесно связаны, и отказ любого из этих путей на ранней стадии после резекции печени может снизить способность остаточной печени к регенерации. Следовательно, методы лечения, обеспечивающие нормальную гемостатическую функцию на самой ранней фазе регенерации после резекции печени, могут предложить новую возможность для улучшения регенерации печени.Для подтверждения этой гипотезы необходимы дополнительные исследования по этой теме, а также клиническое обследование.
Онлайн-версия этой статьи содержит информационное дополнение.
Расходы на публикацию этой статьи были частично оплачены за счет оплаты страницы. Таким образом, исключительно для того, чтобы указать на этот факт, данная статья помечена как «реклама» в соответствии с разделом 18 USC 1734.
Авторы выражают признательность за превосходную техническую помощь при прижизненной микроскопии и предоставление мышей CD41 — / — от C. N. Jenne из Департамента микробиологии, иммунологии и инфекционных заболеваний (Университет Калгари, Калгари, штат Алабама, Канада).
Работа частично поддержана грантом Нидерландской организации научных исследований Т.L. (VIDI, 917.11.304), грант Национального института здоровья, Национального института диабета, болезней органов пищеварения и почек компании J.P.L. (R01 DK105099), исследовательский грант EHA от Европейской гематологической ассоциации для D.G. и программа приглашенных ученых Колледжа ветеринарной медицины Мичиганского государственного университета.
Вклад: Все авторы разработали и провели эксперименты; Д.Г., Д.П., П.С., Т.Л. и Дж.П.Л. проанализировали данные; and D.G., D.P., A.K.K., P.S., T.L., and J.P.L. подготовлены начальные разделы рукописи. Все авторы одобрили окончательный вариант рукописи.
Раскрытие информации о конфликте интересов: авторы заявляют об отсутствии конкурирующих финансовых интересов.
Текущий филиал D.G. Университет штата Мичиган, Ист-Лансинг, Мичиган.
Для корреспонденции: Тон Лисман, Лаборатория хирургических исследований, Университетский медицинский центр Гронингена, BA44, Hanzeplein 1, 9713 GZ, Гронинген, Нидерланды; электронная почта: [email protected]; Джеймс П. Луендык, специалист по патобиологии и диагностике, Университет штата Мичиган, здание по безопасности пищевых продуктов и токсикологии, 253, 1129 Farm Ln, East Lansing, MI 48824; электронная почта: [email protected]; и Патрик Старлингер, отделение хирургии Венского медицинского университета, Waehringer Guertel 18-20, 1090 Вена, Австрия; электронная почта: патрик[email protected].
Zacks Small Cap Research — OGEN: новые доклинические данные показывают, что лантибиотик OG253 безопасен и хорошо переносится…
Дэвид Бауц, доктор философииNYSE: OGEN
ПРОЧИТАЙТЕ ПОЛНЫЙ ОТЧЕТ ОБ ИССЛЕДОВАНИИ OGEN
Business Update
80-й пациент, участвующий в исследовании AG013
20 мая 2019 г. : OGEN) объявила о том, что 80-й пациент участвует в продолжающемся Фазе 2 клинического исследования компании AG013, ведущего разрабатываемое ею соединение для профилактики тяжелого мукозита полости рта (ОМ).Кроме того, Всемирная организация здравоохранения предоставила компании общее название dapatifagene navolactibac для AG013. AG013 представляет собой ополаскиватель для полости рта, состоящий из рекомбинантного штамма Lactococcus lactis , который содержит кодирующую последовательность фактора 1 семейства трилистников человека (hTFF1), который постоянно секретируется бактериями. Семейство фактора трилистника (TFF) представляет собой семейство трех различных пептидов, секретируемых эпителиальными клетками желудочно-кишечного тракта в ответ на повреждение (Hoffman, 2004).Их присутствие было вовлечено в уменьшение повреждений, вызванных химиотерапией и радиацией, как в доклинических исследованиях (Beck et al., 2004), так и в клинических испытаниях (Peterson et al., 2009).
Ожидается, что в испытании фазы 2 (NCT03234465) примут участие примерно 160-180 субъектов с раком головы и шеи, получающих химиотерапию и лучевую терапию, которые будут получать либо AG013 (2,0 x 1011 КОЕ), либо плацебо, вводимое три раза в день в течение 7-9 недель. (в зависимости от плана лечения пациента). За этим последует четырехнедельная фаза наблюдения с долгосрочным наблюдением до 12 месяцев после окончания химиотерапевтического лечения.ОМ будет оцениваться в начале химиотерапевтического лечения и будет продолжаться до тех пор, пока субъект не завершит краткосрочную фазу наблюдения или пока ОМ не исчезнет (оценка ВОЗ ≤ 1). Цель долгосрочного наблюдения — оценить, влияет ли AG013 на ответ опухоли на химиотерапевтическое лечение.
В августе 2018 года Oragenics объявила о возобновлении исследования фазы 2 после положительных результатов промежуточного анализа безопасности, проведенного Советом по мониторингу данных и безопасности (DSMB) у 19 пациентов, включенных в исследование.Безопасность оценивалась на основании нежелательных явлений, возникших в результате лечения, показателей жизненно важных функций, веса, медицинского осмотра, клинических оценок и наличия / отсутствия AG013 в крови. Совет по мониторингу безопасности данных (DSMB) пришел к выводу, что испытание можно продолжить без изменений в протоколе исследования. Частота нежелательных явлений между AG013 и пациентами, получавшими плацебо, была одинаковой. Сообщения о серьезных побочных эффектах были типичными для популяции пациентов с раком головы и шеи, проходящих химиотерапию, и не было сообщений о сепсисе или бактериемии.Особо следует отметить тот факт, что только несколько пациентов прекратили лечение из-за развития тяжелой ОМ, что может быть ранним признаком эффективности.
В октябре 2018 года компания объявила, что получила разрешение от Управления здравоохранения Бельгии на включение жителей Бельгии в испытание фазы 2, а в ноябре 2018 года компания объявила, что получила разрешение на набор пациентов как в Германии, так и в Великобритании. Пациенты начали регистрироваться на этих сайтах в начале 2019 года.Учитывая текущий уровень набора, мы ожидаем основных результатов в первой половине 2020 года.
Публикация освещает переносимость лантибиотика OG253
13 мая 2019 года Oragenics объявила о публикации новых доклинических данных по лантибиотическому соединению OG253. предшественник ведущего лантибиотического соединения компании OG716, в рецензируемом журнале Toxicology and Applied Pharmacology .
В исследовании изучалась переносимость трех доз OG253 у здоровых крыс как в виде однократной, так и в виде семидневной повторной дозы.Препарат вводили три раза в день, и все три дозы (6,75, 27 и 108 мг / день) хорошо переносились без каких-либо связанных с лечением клинических признаков токсичности, включая изменения массы тела или пищевого поведения, как показано на следующий рисунок. Кроме того, не было изменений веса органов, гематологических параметров или гистопатологических свидетельств токсичности в желудочно-кишечном тракте (ЖКТ). Важно отметить, что OG253 не был обнаружен в плазме, что означает, что он остается изолированным в желудочно-кишечном тракте.В результате исследования была рекомендована максимальная переносимая доза 425,7 мг / кг / день.
Посмотреть приложение I
Удивительно, но одним из наблюдаемых эффектов было резкое снижение холестерина и триглицеридов. Среднее снижение триглицеридов и холестерина составило 61,38% и 29,98% соответственно после семи дней лечения OG253. Различия между животными, получавшими OG253 и плацебо, в отношении как триглицеридов ( P = 0,0002), так и холестерина ( P = 0.0002) были статистически значимыми. На данный момент неясно, почему лечение OG253 может вызывать такое резкое снижение холестерина и триглицеридов, хотя ранее было показано, что антибиотики вызывают аналогичный эффект (Jenkins et al., 2005). Исследования механизма этого эффекта в настоящее время продолжаются.
View Exhibit II
OG253 был первоначально разработан как производное мутацина 1140 на основе его способности уничтожать инфекцию Clostridium difficile .К сожалению, OG253 не является активным при пероральном приеме, поскольку препарат расщепляется пищеварительными протеазами. Таким образом, Oragenics выбрала второе соединение, OG716, которое является активным при пероральном приеме, а также активным против C. difficile , и в отношении которого компания в настоящее время продолжает деятельность до IND.
Предпосылки к лантибиотикам
Лантибиотики — это класс пептидных антибиотиков, которые продуцируются некоторыми грамположительными штаммами бактерий. Соединения имеют размер от 22 до 34 аминокислот и обычно проходят ряд посттрансляционных модификаций, которые приводят к новым производным серина и треонина, множественным типам сульфгидрильных связей и наличию необычных аминокислот лантионина (Lan) и B- метиллантионин (MeLan), от которого происходит название лантибиотика.Соединения классифицируются по длине, структуре и термостабильности на тип A, тип B, тип IIa и тип IIb.
Лантибиотики типа A делятся на две подкатегории: соединения, подобные низину A (Gross et al., 1971), и соединения, подобные мутацину 1140 (Smith et al., 2000). Низин А продуцируется Lactobacillus lactis , а мутацин 1140 продуцируется Streptococcus mutans . Структура каждого из этих соединений показана ниже.
View Exhibit III
Лантибиотики проявляют свою бактерицидную активность посредством ряда различных механизмов, включая образование трансмембранных пор, опосредованное липидом II образование пор и абдукцию липида II из физиологических доменов.Лантибиотики типа А имеют чистый положительный заряд, и считается, что для начального связывания требуется электростатическое взаимодействие между положительно заряженным лантибиотиком и отрицательно заряженной мембраной бактериальной клетки. Кроме того, лантибиотики типа А связываются с липидом II (молекула-предшественник в синтезе бактериальной клеточной стенки) и группируют его от бактериальной мембраны, где происходит синтез клеточной стенки, тем самым гарантируя, что липид II недостаточно, и, следовательно, ингибирует рост бактериальных клеток (Hasper et al., 2006). Мутацин 1140, по-видимому, не образует пор, как низин А, что позволяет предположить, что только секвестрация липида II ответственна за его бактерицидную активность. Ванкомицин также нацелен на липид II, однако он находится в уникальном месте, вдали от места связывания лантибиотиков. Кроме того, ванкомицин не изолирует липид II из его нормальных физиологических мест (Daniel et al., 2003).
Ученые знали о лантибиотиках на протяжении десятилетий, однако они не изучались так широко, как другие классы антибиотиков, из-за того, что сложно производить достаточные количества соединений.Как природные молекулы, лантибиотики обычно продуцируются и секретируются в непосредственное окружение клетки, тем самым предотвращая проникновение других бактериальных клеток в область вокруг них. При выращивании в культуре существует мощный механизм обратной связи, который предотвращает выработку бактериями избыточного лантибиотика, который в конечном итоге убьет хозяина. Это приводит к очень низким выходам лантибиотиков при выращивании в культуре, что является серьезным препятствием для их широкого коммерческого использования.Компания Oragenics преодолела это препятствие, разработав методологию производства достаточного количества лантибиотиков, а также в сотрудничестве с Intrexon Corp. она разрабатывает средства для производства лекарств в промышленных масштабах.
Финансовые отчеты
13 мая 2019 года Oragenics подала форму 10-Q с финансовыми результатами за первый квартал 2019 года. Как и ожидалось, компания не отчитывалась о доходах за первый квартал 2019 года. Расходы на НИОКР были 2 доллара.4 миллиона долларов за первый квартал 2019 года по сравнению с 1,3 миллиона долларов за первый квартал 2018 года. Увеличение связано с увеличением затрат на клинические испытания. Расходы на общие и административные расходы в первом квартале 2019 года составили 1,0 млн долларов США по сравнению с 0,8 млн долларов США в первом квартале 2018 года. Увеличение произошло за счет увеличения расходов на консалтинг, компенсацию на основе акций, страхование и заработную плату. Чистый убыток за первый квартал 2019 года составил 3,3 миллиона долларов, или 0,11 доллара на акцию, по сравнению с чистым убытком в размере 2,1 миллиона долларов или 0,42 доллара на акцию в первом квартале 2018 года.
Компания Oragenics вышла из первого квартала 2019 года с примерно 29,3 млн долларов США в виде денежных средств и их эквивалентов. Частично это произошло из-за андеррайтингового публичного размещения акций в марте 2019 года, в результате которого валовая выручка составила 12,5 млн долларов. По нашим оценкам, у компании достаточно капитала для финансирования операций в четвертом квартале 2020 года.
По состоянию на 10 мая 2019 года у Oragenics было около 46,1 миллиона обыкновенных акций в обращении, а с учетом опционов на акции и гарантии полностью разводненное количество акций. из 78.8 миллионов.
Оценка
Мы оцениваем Oragenics, используя модель дисконтированных денежных потоков с поправкой на вероятность, которая учитывает будущие доходы от AG013 и OG716. В целях моделирования мы ожидаем, что AG013 войдет в фазу 3 испытаний в 2020 году, будет подан NDA в 2022 году и получит одобрение в 2023 году в США и Европе, а через год — в Японии. Мы прогнозируем, что клинические испытания OG716 начнутся в 2020 году, подача NDA — в 2024 году, а одобрение — в 2025 году.
В США около 700000 недавно диагностированных больных раком.S., которые потенциально могут разрабатывать OM, еще 1,3 миллиона — в ЕС. и 20 000 в Японии. Пациентам, у которых развивается ОМ, в настоящее время доступно несколько вариантов лечения, помимо паллиативной помощи. Мы считаем, что успешное лечение, которое предотвратило бы заболеваемость ОМ, а также снизило частоту тяжелой ОМ у тех, у кого оно развилось, было бы очень привлекательно для онкологов. Эффективная терапия ОМ может также снизить частоту госпитализаций пациентов, страдающих тяжелой ОМ, и ограничить потребность в уменьшении или прекращении терапии.Мы используем очень консервативную пиковую долю рынка в 5%, среднюю продолжительность использования 60 дней и стоимость 100 долларов в день в США (70 долларов в день и 75 долларов в день для ЕС и Японии соответственно), чтобы достичь пика. мировые продажи составили около 350 миллионов долларов. Использование 13% ставки дисконтирования и 40% вероятности утверждения приводит к чистой приведенной стоимости в 210 миллионов долларов.
Для OG716 мы оцениваем пиковую долю рынка в 10% из примерно 500 000, 200 000 и 100 000 случаев заражения C. difficile ежегодно в США.S., E.U. и Япония соответственно. Мы оцениваем стоимость лечения в 3000, 2000 и 2250 долларов для США, ЕС и Японии соответственно. Это приводит к пиковым мировым доходам примерно в 275 миллионов долларов. Использование ставки дисконтирования 13% и вероятности одобрения 25% приводит к чистой приведенной стоимости в 14 миллионов долларов.
Объединение чистой приведенной стоимости AG013 и OG716 вместе с текущей денежной позицией компании и потенциальными денежными средствами от исполнения варрантов приводит к чистой приведенной стоимости компании в 276 миллионов долларов.Разделение на полностью разводненное количество акций в 78,8 миллиона плюс дополнительные 15 миллионов акций для будущего разводнения дает текущую стоимость в 3,00 доллара за акцию.
ПОДПИСАТЬСЯ НА ZACKS SMALL CAP RESEARCH , чтобы получать наши статьи и отчеты по электронной почте каждое утро. Посетите наш веб-сайт для получения дополнительной информации о Zacks SCR.
РАСКРЫТИЕ ИНФОРМАЦИИ: Zacks SCR получил компенсацию от эмитента напрямую или от привлеченной эмитентом консалтинговой фирмы по связям с инвесторами за предоставление исследовательского покрытия на период не менее одного года.Как видно здесь, исследовательские статьи являются частью услуг, предоставляемых Заком, и Зак получает ежеквартальные платежи на общую сумму не более 30 000 долларов в год за эти услуги. Полный отказ от ответственности ЗДЕСЬ.
Взаимодействие между стрептококками группы А и плазминовой (огеновой) системой способствует вирулентности в модели инфекции кожи мышей | Журнал инфекционных болезней
Аннотация
Стрептококки группы А способны приобретать ассоциированную с поверхностью нерегулируемую плазминоподобную ферментативную активность при инкубации в плазме человека.Эффект этой ферментативной активности на вирулентность изолята группы A CS101 исследовали на модели кожной инфекции мышей. Первоначальные исследования продемонстрировали повышенную вирулентность бактерий, преинкубированных в плазме человека, но не в плазме, обедненной плазминогеном. Прямая корреляция между ферментативной активностью, связанной с поверхностью, и вирулентностью не наблюдалась; однако была отмечена связь между вирулентностью и сборкой ассоциированного с поверхностью активатора плазминогена, который может активировать плазминоген мыши.Эта активность усиливала вирулентность у мышей дикого типа, но не у plg — / — мышей с дефицитом плазминогена. Эти результаты подтверждают гипотезу о том, что приобретение ассоциированной с поверхностью плазмин (оген) -зависимой ферментативной активности может способствовать вирулентности инвазивных стрептококковых инфекций группы А.
Стрептококки группы A могут вызывать целый ряд заболеваний, от легких инфекций горла и кожи до тяжелых и опасных для жизни инвазивных инфекций, а также синдрома токсического шока [1–3].Сообщалось о недавнем возрождении инвазивных инфекций мягких тканей у здоровых людей [4–9]. Недавние исследования в нашей лаборатории показали, что Streptococcus pyogenes может очень специфично взаимодействовать с системой плазмина (оген) человека, приобретая активность поверхностной плазминоподобной протеазы, которая не может регулироваться α 2 -антиплазмин [ 10, 11]. Этот процесс был предложен как возможный механизм, способствующий инвазивному потенциалу организма путем прямого воздействия на внеклеточный матрикс и базальные мембраны или путем активации матриксных металлопротеиназ [12, 13].
Анализ бактериальных факторов и факторов хозяина, необходимых для создания поверхностной плазминоподобной активности, продемонстрировал потребность в двух человеческих кофакторах, фибриногене и плазминогене, а также в двух бактериальных факторах, поверхностном фибриноген-связывающем белке и секретируемом активаторе плазминогена стрептокиназе [ 14–16]. Фибриноген сначала связывается с бактериями, чтобы обеспечить якорное место для комплекса стрептокиназа-плазминоген [15]. Этот комплекс обладает внутренней ферментативной активностью, а также способностью действовать как активатор плазминогена [16] и обеспечивает сопряженный путь, с помощью которого стрептококки группы А могут усиливать свою способность захватывать мощную сериновую протеазу хозяина, плазмин, в форме, которая не может регулироваться α 2 -антиплазмином [17].Эти свойства привели нас к предложению механизма, схематически изображенного на рисунке 1, согласно которому приобретение связанной с поверхностью плазминоподобной ферментативной активности может усиливать инвазивный потенциал стрептококков группы А. Ранее предполагалось, что активация плазминогена является общим свойством как нормальных, так и трансформированных эукариотических клеток, участвующих в преодолении тканевых барьеров [18, 19].
Рисунок 1
Модель для приобретения ассоциированной с поверхностью плазмин (оген) -зависимой ферментативной активности стрептококками группы А, которые могут обеспечивать бактерии с повышенным инвазивным потенциалом.PLG, плазминоген; Fg, фибриноген; СК, стрептокиназа; Fg-связывающий белок, поверхностный связывающий фибриноген белок; Комплекс SK-Plg-Fg, тримолекулярный комплекс стрептокиназы, плазминогена, фибриногена.
Рисунок 1
Модель для приобретения ассоциированной с поверхностью плазмин (оген) -зависимой ферментативной активности стрептококками группы А, которые могут обеспечивать бактерии с повышенным инвазивным потенциалом. PLG, плазминоген; Fg, фибриноген; СК, стрептокиназа; Fg-связывающий белок, поверхностный связывающий фибриноген белок; Комплекс SK-Plg-Fg, тримолекулярный комплекс стрептокиназы, плазминогена, фибриногена.
В исследованиях, описанных в данном документе, мы использовали модель кожной инфекции мыши, которая была разработана в нашей лаборатории для измерения инвазивного потенциала стрептококков группы A [20, 21], чтобы оценить, могут ли бактерии с плазминоподобной активностью на их поверхности были более агрессивными.
Материалы и методы
Бактерии
Во всех исследованиях использовали изолят стрептококка группы А серотипа А, CS101. Этот изолят является положительным по фактору непрозрачности и был тщательно изучен на предмет продуктов ключевых генов, необходимых для приобретения плазмин (оген) -зависимой протеазной активности при инкубации в плазме человека [15].Бактерии выращивали в течение ночи в бульоне Тодда-Хьюитта при 37 ° C в качестве стационарных культур.
Общие реагенты
Плазма мыши была приобретена у Calbiochem (Ла-Холья, Калифорния). Человеческая плазма была получена из Американского Красного Креста (Толедо, Огайо), и единицы от 3 отдельных доноров были объединены. Мышиный и человеческий плазминоген очищали, пропуская соответствующий источник плазмы через колонку лизин-сефарозу (Pharmacia, Piscataway, NJ) и элюируя связанный плазминоген 0.2 M ε-аминокапроновая кислота, как описано ранее [22]. Свободный от плазминогена фибриноген (Calbiochem) дополнительно очищали путем пропускания через колонку лизин-сефароза для удаления любых следов контаминирующего плазминогена. Синтетический плазмин-селективный субстрат, H -D-Val-Leu-Lys- пара -нитроанилид (S-2251), был получен от Kabi Pharmacia (Франклин, Огайо). Урокиназа была приобретена у Sigma (Сент-Луис).
Препарат стрептокиназы
Рекомбинантная стрептокиназа группы A была клонирована из изолята стрептококка группы A CS101 и экспрессирована в Escherichia coli DH5 α , как описано ранее [15].Соответствующую форму стрептокиназы дикого типа очищали из среды ночной культуры изолята CS101, выращенного в среде определенного химического состава (Hazleton Research Products, Lenexa, KS) при 37 ° C в течение 6-8 часов, как описано ранее [15]. Затем бактерии осаждали центрифугированием (9000 г в течение 10 минут), и свободный от бактерий супернатант концентрировали в ~ 50 раз с использованием концентратора с молекулярным отсечением ~ 10,000 (Amicon, Беверли, Массачусетс). Затем супернатанты фильтровали через 0.2- мкм мкм и хранятся при -20 ° C для последующего использования. Контрольный препарат, полученный инкубацией изогенного мутанта изолята CS101, в котором был инактивирован ген ska , обрабатывали идентичным образом и использовали в качестве контроля [15]. Стрептокиназа, выделенная из культуральной жидкости изолята стрептококка группы C, была приобретена у Sigma.
Характеристика препаратов стрептокиназы
Препараты рекомбинантной стрептокиназы и стрептокиназы дикого типа были охарактеризованы функционально и антигенно.Функциональный анализ измерял способность генерировать плазмин из плазминогена в жидкой фазе (см. Ниже). Антигенный анализ проводили путем разделения препаратов стрептокиназы на 10% SDS-полиакриламидных гелях, переноса на нитроцеллюлозную мембрану с помощью электроблоттинга, а затем зондирования блота человеческой антисывороткой, содержащей специфические антитела к стрептокиназе. Любые полученные специфические комплексы антиген-антитело детектировали с помощью усиленного хемилюминесцентного анализа (Pierce, Rockford, IL) с использованием зонда белок G — пероксидаза хрена.
Измерение активации плазминогена
Активацию плазминогена мыши или человека стрептокиназой или урокиназой проводили в жидкой фазе, как описано ранее [23, 24]. Вкратце, аликвоты 100- мкл л с разными концентрациями очищенного плазминогена человека или мыши инкубировали с разными концентрациями стрептокиназы или урокиназы (200 единиц плуга) и смешивали с 100 мкл мкл S-2251 в PBS (0,01 мкМ). , pH 7.6) с получением конечной концентрации 400 мкМ субстрата . Превращение плазминогена в плазмин измеряли на микропланшет-ридере (Bio-Kinetics EL-312; Bio-Tek, Winooski, VT) путем гидролиза S-2251, измеренного по изменению оптической плотности при 405 нм ( A 405 ) с течением времени при 37 ° C. Этот анализ демонстрирует линейность плазмина как человека, так и мыши по отношению к A 405 по меньшей мере 1,25; При использовании урокиназы в качестве активатора плазминогена не было отмечено значительных различий в способности количественно определять плазмин человека и мыши.
Анализ активности протеаз, ассоциированных с бактериальной поверхностью
Активность ассоциированной с поверхностью плазминоподобной протеазы измеряли, как описано ранее [25]. Вкратце, 10 8 КОЕ бактерий инкубировали с различными комбинациями человеческой плазмы или очищенного фибриногена или плазминогена с экзогенной стрептокиназой или без нее при 37 ° C в течение указанного времени. Бактерии осаждали центрифугированием и трижды промывали PBS перед ресуспендированием бактериального осадка в 400 мкл л плазмин-селективного субстрата S-2251 (400 мкМ ) и инкубировали в течение фиксированного времени при 37 ° C.Затем измеряли расщепление S-2251, измеряя A 405 из 100 мкл л супернатанта, свободного от бактерий, в считывающем устройстве для микропланшетов.
Измерение бактериальной активности активатора плазминогена
Бактерии были предварительно обработаны различными комбинациями реагентов, как описано выше, для создания поверхностно-ассоциированной протеазной активности. Клетки осаждали, трижды промывали PBS, а затем инкубировали с плазминогеном мыши или человека (10%) или плазминогеном мыши или человека (10 мкг, мкг / мл) в 400 мкл л буфера PBS при 37 °. C в течение 30 мин.Затем бактерии осаждали, 100 мкл мкл свободных от бактерий супернатантов инкубировали с S-2251 при 37 ° C, и A 405 контролировали с течением времени. Активацию плазминогена определяли гидролизом плазмин-селективного субстрата, S-2251, как описано выше.
Мышиная модель кожной инфекции
Мышиная модель кожной инфекции была описана ранее [20, 21]. Самки беспородных мышей CD1 (возраст 6-8 недель, вес 20-24 г) были получены от Charles River Laboratories (Portage, MI).Для этих экспериментов бактерии предварительно обрабатывали перед инъекцией мышам следующим образом: изолят CS101, выращенный в 300 мл бульона Тодда-Хьюитта, инкубировали при 37 ° C в качестве стационарной культуры в течение 14–16 часов. Затем бактерии осаждали (9000 г в течение 20 мин при 4 ° C) и дважды промывали стерильным PBS (0,01 M , pH 7,6). Затем бактерии ресуспендировали в PBS и доводили до концентрации, эквивалентной 10 9 КОЕ / мл, корректируя A 550 с ранее определенной нонаграммой.Бактериальную суспензию разделяли на аликвоты, и образцы инкубировали с различными комбинациями реагентов в течение 30 мин при 37 ° C. После этой предварительной обработки бактерии осаждали центрифугированием при 5000 g в течение 15 мин при 4 ° C, трижды промывали буфером PBS и затем ресуспендировали до исходного объема в PBS. Предварительно обработанные бактерии вводили в воздушный мешок кожи мыши, как описано ранее [21]. По существу, каждой мыши внутрикожно вводили 0,1 мл предварительно обработанных бактерий (что эквивалентно 10 8 КОЕ) с 0.9 мл воздуха, чтобы создать кожный воздушный мешок на боку мыши. Для каждого условия лечения использовали группы из 10 беспородных мышей CD1. Время до смерти инфицированных мышей отслеживали.
Подобные исследования были также проведены с трансгенными мышами, у которых ген плазминогена был инактивирован. Генерация и характеристика этих мышей были описаны ранее [26].
Весь статистический анализ проводился с помощью StatView SE + Graphics, версия 4.5 (Abacus Concepts, Беркли, Калифорния). Различия между группами сравнивали по среднему проценту выживаемости.Для оценки значимости использовался либо дисперсионный анализ, либо сравнение непарных средних, и P <0,05 считалось статистически значимым.
Результаты
Описанные здесь эксперименты были разработаны для проверки гипотезы о том, что способность стрептококков группы А приобретать ассоциированную с поверхностью плазминоподобную ферментативную активность будет способствовать инвазии. Однако предыдущие исследования показали, что стрептокиназа, секретируемая S. pyogenes , выделенным от человека, не активирует напрямую нечеловеческие источники плазминогена [27, 28].В предварительных исследованиях с использованием либо стрептокиназы дикого типа, очищенной из культуральной среды изолята стрептококка группы C, либо рекомбинантной стрептокиназы, клонированной из изолята CS101 группы A M49 и экспрессированной в E. coli , мы обнаружили, что ни один из этих источников активатора плазминогена не может активировать мышь. плазминоген (данные не показаны). Следовательно, чтобы проверить значение приобретения плазминоподобной ферментативной активности на инвазивный потенциал стрептококков группы А, мы использовали двухэтапный экспериментальный план.На начальной стадии in vitro стрептококки группы A инкубировали с человеческой плазмой для создания поверхностной плазмин (оген) -зависимой ферментативной активности, а затем на второй стадии обработанные или необработанные бактерии тестировали на вирулентность после инъекции в воздух кожи мыши. мешок.
В начальных экспериментах изолят CS101 инкубировали при 37 ° C в течение 30 минут либо с буфером, либо с 30% плазмой человека, либо с 30% обедненной плазминогеном плазмой человека с экзогенной стрептокиназой или без нее (100 Ед / мл). В это время бактерии были тщательно промыты и ресуспендированы в стерильном буфере PBS (0.01 M , pH 7,6) и аликвоту 10 8 КОЕ вводили в кожный воздушный мешок. Каждая экспериментальная группа состояла из 10 беспородных мышей CD1. Аликвоту бактерий (10 8 КОЕ) из каждой группы предварительной обработки также тестировали на ассоциированную с поверхностью плазминоподобную ферментативную активность путем измерения гидролиза плазмин-селективного синтетического субстрата, S-2251, как описано в разделе «Материалы и методы».
Как показано на рисунке 2А, наблюдались заметные различия в количестве связанной с поверхностью ферментативной активности между бактериями, предварительно обработанными в различных условиях.После 30 мин инкубации при 37 ° C стрептококки, инкубированные в плазме человека плюс экзогенная стрептокиназа, приобрели наивысшую поверхностно-ассоциированную ферментативную активность, определяемую расщеплением субстрата S-2251, тогда как другие группы показали значительно более низкую или необнаруживаемую поверхностно-ассоциированную ферментативную активность. .
Рисунок 2
Влияние предварительной обработки бактерий различными комбинациями буфера, человеческой плазмы или плазминоген-обедненной плазмы со стрептокиназой или без нее на их способность расщеплять плазмин-селективный синтетический субстрат S2251 (A) или вызывать летальную инфекцию у мышей модель кожной инфекции (B).A: Измерение ассоциированной с клетками плазминоподобной ферментативной активности бактерий, предварительно обработанных либо человеческой плазмой, либо плазминоген-истощенной человеческой плазмой, либо PBS, с экзогенной стрептокиназой или без нее (100 Ед / мл). Бактерии промывали и определяли ассоциированную с клетками ферментативную активность путем измерения гидролиза плазмин-селективного синтетического субстрата, H -D-Val-Leu-Lys- пара -нитроанилида (S-2251). СК, стрептокиназа; PLM, человеческая плазма; PLG-D, человеческая плазма, обедненная плазминогеном; OD, оптическая плотность.Все эксперименты проводились в двух экземплярах, и между образцами было отмечено <5% отклонений. B: Сравнение вирулентности бактерий, предварительно обработанных человеческой плазмой, человеческой плазмой, обедненной плазминогеном, или PBS, с экзогенной стрептокиназой (100 Ед / мл) или без нее перед инъекцией в воздушный мешок кожи. СК, стрептокиназа; PLM, человеческая плазма; PLG-D, человеческая плазма, обедненная плазминогеном. Бактерии предварительно обрабатывали, промывали и вводили в количестве 10 8 КОЕ в воздушный мешок кожи мыши каждой из 10 беспородных мышей CD1.За мышами наблюдали время до смерти. Сравнение данных о значимых различиях между группами было выполнено с помощью StatView SE + Graphics. Статистически значимая разница наблюдалась между группами, которым вводили бактерии, предварительно инкубированные в плазме человека ( P <0,05), и бактерии, предварительно инкубированные либо в PBS, либо в одной стрептокиназе, либо в плазме, обедненной плазминогеном. Бактерии, предварительно инкубированные либо с человеческой плазмой, содержащей экзогенную стрептокиназу, либо с человеческой плазмой, обедненной плазминогеном, содержащей экзогенную стрептокиназу, были более вирулентными ( P <.01), чем бактерии, предварительно обработанные одним PBS, одной стрептокиназой или одной плазмой, обедненной плазминогеном.
Рисунок 2
Влияние предварительной обработки бактерий различными комбинациями буфера, человеческой плазмы или плазминоген-обедненной плазмы со стрептокиназой или без нее на их способность расщеплять плазмин-селективный синтетический субстрат S2251 (A) или вызывать летальную инфекцию в модель инфекции кожи мыши (B). A: Измерение ассоциированной с клетками плазминоподобной ферментативной активности бактерий, предварительно обработанных либо человеческой плазмой, либо плазминоген-истощенной человеческой плазмой, либо PBS, с экзогенной стрептокиназой или без нее (100 Ед / мл).Бактерии промывали и определяли ассоциированную с клетками ферментативную активность путем измерения гидролиза плазмин-селективного синтетического субстрата, H -D-Val-Leu-Lys- пара -нитроанилида (S-2251). СК, стрептокиназа; PLM, человеческая плазма; PLG-D, человеческая плазма, обедненная плазминогеном; OD, оптическая плотность. Все эксперименты проводились в двух экземплярах, и между образцами было отмечено <5% отклонений. B: Сравнение вирулентности бактерий, предварительно обработанных человеческой плазмой, человеческой плазмой, обедненной плазминогеном, или PBS, с экзогенной стрептокиназой (100 Ед / мл) или без нее перед инъекцией в воздушный мешок кожи.СК, стрептокиназа; PLM, человеческая плазма; PLG-D, человеческая плазма, обедненная плазминогеном. Бактерии предварительно обрабатывали, промывали и вводили в количестве 10 8 КОЕ в воздушный мешок кожи мыши каждой из 10 беспородных мышей CD1. За мышами наблюдали время до смерти. Сравнение данных о значимых различиях между группами было выполнено с помощью StatView SE + Graphics. Статистически значимая разница наблюдалась между группами, которым вводили бактерии, предварительно инкубированные в плазме человека ( P <.05) и бактерии, предварительно инкубированные либо в PBS, либо в одной стрептокиназе, либо в плазме, обедненной плазминогеном. Бактерии, предварительно инкубированные либо с человеческой плазмой, содержащей экзогенную стрептокиназу, либо с обедненной плазминогеном плазмой человека, содержащей экзогенную стрептокиназу, были более вирулентными ( P <0,01), чем бактерии, предварительно обработанные только PBS, одной стрептокиназой или одной плазмой, обедненной плазминогеном.
Влияние предварительной обработки in vitro на вирулентность изолята CS101 группы А, введенного в кожный воздушный мешок, показано для репрезентативного эксперимента на рисунке 2В.Анализ данных показывает, что статистически значимая разница ( P <0,05) наблюдалась между бактериями, предварительно инкубированными в плазме, и бактериями, предварительно инкубированными либо с PBS, либо с плазмой, обедненной плазминогеном. Эти результаты предполагают, что плазминоген-зависимая активность, приобретенная во время фазы преинкубации in vitro, может увеличивать потенциал вирулентности бактерий. Если к смеси для предварительной инкубации добавляли экзогенную стрептокиназу, наблюдалось значительное повышение вирулентности стрептококков, предварительно инкубированных с человеческой плазмой и стрептокиназой ( P <.01) или, что удивительно, с плазмой, обедненной плазминогеном, плюс стрептокиназа ( P <0,01) по сравнению с вирулентностью бактерий, предварительно инкубированных либо с одним PBS, либо с одной стрептокиназой, либо с одной только плазминоген-истощенной плазмой (фигура 2B).
Сравнение между ферментативной активностью, связанной с поверхностью (рис. 2А), и вирулентностью не продемонстрировало какой-либо четкой корреляции. Значительная ферментативная активность наблюдалась только в экспериментальной группе, предварительно инкубированной с плазмой и экзогенной стрептокиназой.Низкий уровень активности наблюдался для группы, инкубированной в плазме, обедненной плазминогеном, плюс стрептокиназа, что указывает на то, что процесс истощения плазминогена не был эффективным на 100%.
Этот эксперимент был повторен, и аналогичная картина повышенной вирулентности была отмечена для бактерий, предварительно инкубированных в плазме человека с добавлением стрептокиназы или без нее, или для бактерий, предварительно инкубированных с плазминоген-обедненной плазмой человека плюс стрептокиназа, но не в отсутствие активатора плазминогена. (данные не показаны).
Неспособность продемонстрировать прямую связь между ферментативной активностью, полученной на этапе предварительной обработки in vitro, и характером инфекции предполагает, что либо свойство не было важным, либо низкий пороговый уровень был достаточен либо для инициации инвазии, либо для облегчения взаимодействия с факторами присутствуют в месте заражения, чтобы усилить вирулентность обработанных организмов.
В нашей лаборатории показано, что S. pyogenes , инкубированные в плазме человека, могут приобретать поверхностную активность активатора плазминогена [16, 17].Возможно, что этот связанный с поверхностью ферментный комплекс может активировать плазминоген мыши и что вторичная активация системы плазминогена мыши может влиять на течение инфекции. Чтобы проверить эту гипотезу, бактериальный изолят CS101 сначала инкубировали с человеческой плазмой или плазминоген-обедненной человеческой плазмой с экзогенной стрептокиназой или без нее при 37 ° C в течение 30 минут в условиях, описанных выше. Затем бактерии тщательно промывали для удаления белков плазмы в жидкой фазе и стрептокиназы.Промытый бактериальный осадок ресуспендировали в буфере, содержащем плазминоген мыши (10 мкг мкг / мл), и инкубировали в течение 30 мин при 37 ° C. Свободный от бактерий супернатант собирали и инкубировали с плазмин-селективным синтетическим субстратом S-2251 для мониторинга активации плазминогена мыши.
Результаты, представленные на рисунке 3, демонстрируют, что бактерии, предварительно инкубированные в плазме человека с экзогенной стрептокиназой, приобрели активность поверхностного активатора плазминогена, способного превращать плазминоген мыши в плазмин, тогда как бактерии, предварительно инкубированные в плазмино-обедненной плазме без стрептокиназы или бактерии, инкубированные только со стрептокиназой, оказались неэффективными. для приобретения активности активатора плазминогена на поверхности мыши.Интересно, что бактерии, инкубированные в плазмино-обедненной плазме со стрептокиназой, действительно приобрели активность поверхностного активатора плазминогена, которая была способна активировать плазминоген мыши (рис. 3). Низкий уровень активности активатора плазминогена, связанный с бактериями, предварительно инкубированными с человеческой плазмой, но не с обедненной плазминогеном плазмой в отсутствие экзогенной стрептокиназы, был обнаружен, когда анализ, описанный на рисунке 3, продолжался в течение 5-часового инкубационного периода (данные не показаны). .
Рисунок 3
Кинетика активации мышиного плазминогена комплексом поверхностно-ассоциированный плазминоген-активатор.Бактерии инкубировали с различными комбинациями плазмы человека или плазмы, обедненной плазминогеном, с добавленной стрептокиназой или без нее. После инкубации бактерии промывали и тестировали на их способность превращать плазминоген мыши (10 мкг мкг / мл) в плазмин. Активность плазмина количественно определяли гидролизом плазмин-селективного синтетического субстрата H -D-Val-Leu-Lys- пара -нитроанилида (S-2251). СК, стрептокиназа; PLM, человеческая плазма; PLG-D, человеческая плазма, обедненная плазминогеном.
Рисунок 3
Кинетика активации плазминогена мыши с помощью комплекса плазминоген-активатор, ассоциированного с поверхностью. Бактерии инкубировали с различными комбинациями плазмы человека или плазмы, обедненной плазминогеном, с добавленной стрептокиназой или без нее. После инкубации бактерии промывали и тестировали на их способность превращать плазминоген мыши (10 мкг мкг / мл) в плазмин. Активность плазмина количественно определяли гидролизом плазмин-селективного синтетического субстрата H -D-Val-Leu-Lys- пара -нитроанилида (S-2251).СК, стрептокиназа; PLM, человеческая плазма; PLG-D, человеческая плазма, обедненная плазминогеном.
Если бы активность мышиного активатора плазминогена была важна для повышения вирулентности, и этот активатор мог быть собран при низком уровне плазминогена человека (<1 мк мкг / мл), эти результаты объяснили бы неожиданные результаты (рисунок 2) получены с использованием плазмы, обедненной плазминогеном. Чтобы проверить эту гипотезу, была протестирована способность собирать комплекс поверхностного мышиного плазминогена-активатора с использованием очищенных белков человека.В предварительных исследованиях можно было собрать поверхностный комплекс, способный активировать плазминоген мыши, и продемонстрировать абсолютную потребность в фибриногене, плазминогене и стрептокиназе (данные не показаны).
В следующей серии исследований бактерии, инкубированные с различными комбинациями человеческого плазминогена, фибриногена и / или стрептокиназы, тестировали на их способность повышать вирулентность на модели воздушного мешка кожи мыши. Бактерии, предварительно инкубированные с 50 мкг / мл фибриногена или 10 мкг мкг / мл плазминогена с или без 5 Ед стрептокиназы в течение 30 минут при 37 ° C, сравнивали на вирулентность при введении в кожный воздушный мешок в группах из 10 беспородных животных. Мыши CD1.Эти условия были выбраны из предварительных исследований для определения минимального количества стрептокиназы, необходимого для сборки мышиного комплекса плазминоген-активатор на предварительно обработанных бактериях. Результаты, представленные на фиг. 4A, демонстрируют, что бактерии, предварительно инкубированные с человеческим фибриногеном, плазминогеном и стрептокиназой, были значительно более инвазивными, чем необработанные бактерии ( P <0,01). Предварительная инкубация бактерий с любой комбинацией двух из трех реагентов не привела к какому-либо значительному изменению вирулентности при тестировании на модели инфекции кожи мышей (фигура 4A).Аликвоты бактерий, предварительно обработанные каждой комбинацией реагентов, также тестировали на их способность активировать плазминоген мыши. Как показано на фиг. 4B, только бактерии, инкубированные с фибриногеном, плазминогеном и стрептокиназой, продемонстрировали ассоциированную с поверхностью активность активатора плазминогена, способную генерировать плазмин из плазминогена мыши.
Рисунок 4
Влияние предварительной обработки стрептококкового изолята CS101 группы А с очищенным фибриногеном, плазминогеном и / или стрептокиназой на способность бактерий вызывать летальную кожную инфекцию (A) или способность собирать поверхностный комплекс плазминогена с активатором, способный активировать плазминоген мыши (B) .Бактерии были предварительно обработаны различными комбинациями человеческого фибриногена (F или Fg; 50 μ мкг / мл), плазминогена (P или Plg; 10 μ мкг / мл) и стрептокиназы (SK; 5 U), как показано. Аликвоту, содержащую 10 8 КОЕ бактерий, тестировали на потенциал мышиного активатора плазминогена; вторую аликвоту, содержащую 10 8 КОЕ бактерий, вводили в кожный воздушный мешок каждой из 10 беспородных мышей CD1 и отслеживали время до смерти после заражения. OD, оптическая плотность. Статистически значимое влияние на вирулентность наблюдали только в группах мышей, инфицированных бактериями, предварительно обработанными фибриногеном, плазминогеном и стрептокиназой ( P <.01).
Рисунок 4
Влияние предварительной обработки стрептококкового изолята CS101 группы А с очищенным фибриногеном, плазминогеном и / или стрептокиназой на способность бактерий вызывать летальную кожную инфекцию (A) или способность собирать поверхностный комплекс плазминогена с активатором, способный к активирующий плазминоген мыши (B) . Бактерии были предварительно обработаны различными комбинациями человеческого фибриногена (F или Fg; 50 μ мкг / мл), плазминогена (P или Plg; 10 μ мкг / мл) и стрептокиназы (SK; 5 U), как показано.Аликвоту, содержащую 10 8 КОЕ бактерий, тестировали на потенциал активатора плазминогена мыши; вторую аликвоту, содержащую 10 8 КОЕ бактерий, вводили в кожный воздушный мешок каждой из 10 беспородных мышей CD1 и отслеживали время до смерти после заражения. OD, оптическая плотность. Статистически значимые эффекты на вирулентность наблюдались только в группах мышей, инфицированных бактериями, предварительно обработанными фибриногеном, плазминогеном и стрептокиназой ( P <0,01).
Эти эксперименты были выполнены со стрептокиназой дикого типа, выделенной из изолята стрептококка группы C, а также с рекомбинантной стрептокиназой, клонированной из изолята группы A CS101 и экспрессированной в E.coli . Аналогичные результаты были получены во всех экспериментах, и значительное влияние на вирулентность наблюдалось только для организмов, предварительно обработанных фибриногеном, стрептокиназой и плазминогеном. Это также была единственная комбинация реагентов, которая приводила к образованию ассоциированного с клеткой комплекса, способного активировать плазминоген мыши (данные не показаны).
Взятые вместе, все представленные эксперименты предполагают, что способность стрептококков группы А активировать плазминоген в коже инфицированного хозяина повысит их способность распространяться и вызывать инвазивную инфекцию.Эти результаты предсказывают, что способность изолята стрептококка группы A CS101 с активностью поверхностного активатора плазминогена будет значительно менее вирулентной у трансгенных мышей plg — / — , лишенных плазминогена, чем у их дикого типа plg + / + однопометников. В предварительных исследованиях были обнаружены достоверные различия в LD 50 s изолята CS101 для plg — / — и plg + / + однопометников.Для мышей plg — / — LD 50 составляла 10 7 КОЕ, тогда как у однопометников дикого типа LD 50 составляла ~ 10 8 КОЕ (данные не показаны). Это различие не было неожиданным, поскольку совпадающие по возрасту мыши plg — / — были меньше и казались бегающими по сравнению с их однопометниками дикого типа, а мыши plg — / — , как известно, также демонстрируют различия в воспалительных ответах. [26, 29].
Следовательно, чтобы проверить влияние активности поверхностного активатора плазминогена на инвазивный потенциал, мы сравнили вирулентность инокулята CS101 с 10 7 КОЕ, предварительно инкубированного с человеческой плазмой, и экзогенной стрептокиназой на вирулентность либо дикого типа, либо plg — / — трансгенных мышей.Эта контрольная доза представляла собой LD 50 для мышей plg — / — , тогда как этот инокулят не смог убить ни одной мыши дикого типа в предварительных исследованиях. Обоснованием этого эксперимента было то, что если активация плазминогена способствовала инвазивному потенциалу, то не было бы ожидаемого повышения вирулентности у мышей plg — / — , тогда как более инвазивная инфекция у мышей plg + / + было бы предсказано. Результаты, представленные в таблице 1, демонстрируют, что наличие активности активатора плазминогена на поверхности изолята CS101 привело к гибели 3 из 6 мышей plg — / — в ходе эксперимента.Этот результат ожидался на основании использования контрольной дозы на уровне LD 50 для мышей plg — / — . Когда эти предварительно обработанные бактерии вводили в кожу нормальных однопометников дикого типа, наблюдалась гибель 4 из 6 (таблица 1). Этот результат резко контрастирует с инъекцией необработанных бактерий, которым не удалось убить ни одной мыши дикого типа при этой дозе. Предварительно обработанные бактерии были способны активировать плазминоген мыши (данные не показаны).
Таблица 1
Вирулентность изолята CS101, предварительно обработанного человеческой плазмой и экзогенной стрептокиназой, у мышей дикого типа plg + / + и plg — / — .
Таблица 1
Вирулентность изолята CS101, предварительно обработанного человеческой плазмой и экзогенной стрептокиназой, у мышей дикого типа plg + / + и plg — / — .
В конце эксперимента всех выживших мышей умерщвляли, а их селезенки культивировали. Жизнеспособные стрептококки были выделены у каждой из 2 выживших мышей plg + / + , тогда как ни у одной из выживших мышей plg — / — не было обнаруживаемых бактерий в селезенках.Эти результаты показывают, что наличие интактной системы плазминогена у инфицированного хозяина может влиять на характер инфекции.
Обсуждение
Способность ряда инвазивных патогенов человека взаимодействовать с системой плазминогена хозяина была предложена в качестве потенциальной общей стратегии вирулентности, позволяющей организмам проникать через тканевые барьеры [12, 13]. Было показано, что стрептококки группы А способны к очень сложному взаимодействию с системой плазмина (огена) человека.Организмы группы А, инкубированные в плазме человека, приобретают поверхностную активность активатора плазминогена в многоэтапном процессе (см. Рисунок 1). Первоначально фибриноген связывается с поверхностным фибриноген-связывающим белком, образуя место для закрепления комплекса стрептокиназа-плазминоген. Этого можно достичь с помощью стрептокиназы, продуцируемой эндогенно или экзогенно [11, 14, 15, 17].
Поверхностный ферментный комплекс, собранный в плазме человека, обладает внутренней ферментативной активностью, а также потенциалом активатора плазминогена для плазминогена человека и мыши.Кроме того, комплекс поверхностный плазминоген-активатор стабилен в плазме человека при 37 ° C и также может превращать плазминоген в плазме в плазмин, который может связываться с поверхностными плазмин-связывающими структурами, несмотря на присутствие α 2 -антиплазмин и другие серпины в реакционной смеси [14, 16, 17]. Этот очень сложный механизм приобретения нерегулируемой ферментативной активности хозяина с широкой субстратной специфичностью был постулирован как потенциальный механизм, с помощью которого стрептококки группы А могут приобретать инвазивный потенциал [12, 13].
Чтобы проверить это предсказание, мы использовали установленную мышиную модель стрептококковой инфекции кожи группы А [20, 21]. Однако, поскольку стрептокиназа из изолятов S. pyogenes не может активировать плазминоген мыши непосредственно в жидкой фазе, предсказания этой гипотезы не могут быть проверены непосредственно на мышиной модели. Следовательно, в начальных экспериментах использовалась двухэтапная стратегия. На первой стадии in vitro бактерии предварительно инкубировали с человеческой плазмой или плазминоген-обедненной плазмой в присутствии или в отсутствие экзогенной стрептокиназы, чтобы обеспечить сборку поверхностного ферментативного комплекса.Затем обработанные бактерии отмывали от несвязавшихся белков человека и тестировали на влияние на вирулентность на второй стадии in vivo.
Первоначальные исследования показали, что присутствие плазминогена в реакции преинкубации оказало значительное влияние на вирулентность стрептококков группы А при введении в кожный воздушный мешок (рис. 2). Бактерии, предварительно инкубированные в плазме, были значительно более вирулентными, чем те, которые были предварительно инкубированы в плазме, обедненной плазминогеном ( P <0,05) или только в буфере ( P <.05). В параллельных исследованиях значительно повышенная вирулентность по сравнению с необработанными бактериями была отмечена для бактерий, предварительно инкубированных либо с плазмой ( P <0,01), либо с плазмой, обедненной плазминогеном ( P <0,01), к которой была добавлена экзогенная стрептокиназа. Бактерии, предварительно инкубированные только со стрептокиназой, не оказали значительного эффекта ( P > 0,05).
Первоначальные попытки сопоставить абсолютное количество поверхностной ферментативной активности, полученной in vitro, с вирулентностью, измеренной in vivo, не продемонстрировали прямой связи.Кроме того, особенно интересны результаты, полученные с бактериями, инкубируемыми с плазмой, обедненной плазминогеном, к которой была добавлена экзогенная стрептокиназа. Эти бактерии демонстрируют значительно повышенную вирулентность ( P <0,01) по сравнению с необработанными бактериями, а также низкий, но обнаруживаемый уровень ферментативной активности (рис. 3). Из-за низких уровней ферментативной активности, обнаруженных в используемых экспериментальных условиях, было проверено потенциальное взаимодействие между ферментативной активностью и факторами хозяина у мышей.
Хотя стрептокиназа из изолятов S. pyogenes , инкубированных в жидкой фазе с плазминогеном мыши, не вырабатывала плазмин, мы обнаружили, что бактерии, предварительно инкубированные с человеческой плазмой, могут собирать поверхностный комплекс плазминогена-активатора, который может активировать плазминоген мыши (рис. 3). Эта активаторная активность была обнаружена для бактерий, инкубированных либо с человеческой плазмой, либо с плазминоген-обедненной плазмой, к которой была добавлена экзогенная стрептокиназа. В исследованиях с использованием очищенного фибриногена, плазминогена и экзогенной стрептокиназы мы подтвердили, что все три реагента необходимы для сборки связанной с бактериями активности активатора плазминогена, которая может активировать плазминоген мыши.Эти исследования также продемонстрировали, что эта активность может быть собрана, когда присутствуют следовые уровни плазминогена (0,1 мкг мкг / мл), при условии, что также добавлен источник фибриногена и экзогенная стрептокиназа (данные не показаны). Бактерии с активностью поверхностного активатора плазминогена, генерируемые инкубацией с очищенным фибриногеном, плазминогеном и стрептокиназой, также были значительно более вирулентными в модели инфекции кожи мышей.
Поскольку активаторный комплекс может быть собран со следовыми уровнями плазминогена, это может происходить на многих участках инфекции.Кроме того, исследования бактерий, предварительно инкубированных в плазме человека без добавления стрептокиназы в течение 30 минут при 37 ° C, продемонстрировали, что может быть собран низкий уровень активности мышиного плазминогена-активатора, что коррелирует с повышенной вирулентностью в условиях, при которых только низкие уровни стрептокиназы будет произведено. Эти данные свидетельствуют о том, что стрептококки группы A очень эффективны в приобретении зависимых от плазминогена активностей, которые вносят вклад в вирулентность у мышей.
Недавно были созданы трансгенные мыши, у которых был инактивирован ген плазминогена [26, 29].Эти мыши оказались очень ценными при анализе роли плазминогена в различных биологических процессах [29–33]. Существуют значительные различия в размере и общем состоянии здоровья мышей plg — / — и их однопометников дикого типа. В целом, мыши plg — / — кажутся беглыми, и в этом исследовании мы обнаружили значительную разницу в их чувствительности к изоляту группы A CS101. LD 50 для однопометников дикого типа составлял 10 8 КОЕ, тогда как LD 50 для мышей plg — / — составлял 10 7 КОЕ.Это различие позволяет проводить прямые сравнения между мышами дикого типа и мышами plg — / — на предмет восприимчивости к комплексу инфекции. Однако можно оценить, увеличивает ли способность активировать плазминоген мыши вирулентность. В этом исследовании мы обнаружили, что присутствие комплекса мышиного плазминогена с активатором на поверхности изолята CS101 увеличивает вирулентность организма у мышей дикого типа, не оказывая заметного воздействия на группу plg — / — (Таблица 1).
Доказательства роли системы плазминогена в инвазивных инфекциях также были предложены в других инфекционных моделях. На мышиной модели болезни Лайма Coleman et al. [34] показали важность плазминогена в распространении паразита от клещевого вектора. В связанных исследованиях Sodeinde et al. [35] и Gougen et al. [36], используя модель кожи инфекции Yersinia pestis , также предоставили доказательства важности активации плазминогена при инвазии.Другие исследования Gyetko et al. [37], используя модель инфекции легких Cryptococcus neoformans , также предположили роль системы активатора плазминогена урокиназы в успешной защите хозяина от этого патогена на модели легких. Взятые вместе, эти исследования предполагают, что патогены, способные активировать плазминоген в инфицированном хозяине или способные приобретать плазмин хозяина каким-либо другим механизмом, могут иметь избирательное преимущество при преодолении тканевых барьеров и возникновении диссеминированных инфекций.
Благодарности
Мы благодарим Ричарда Лоттенберга (Университет Флориды, Медицинский колледж) за полезные обсуждения и Кэрол Хепнер за подготовку рукописи.
Список литературы
1.,.Стрептококковые инфекции кожи и мягких тканей
,N Engl J Med
,1996
, vol.334
(стр.240
—5
) 2 ..Стрептококк группы A: от фундаментальной науки к клинической болезни
,West J Med
,1996
, vol.164
(стр.25
—7
) 3.,,.Тяжелая инвазивная болезнь, стрептококковая группа А: клиническое описание и механизмы патогенеза
,J Lab Clin Med
,1996
, vol.127
(стр.13
—22
) 4.,,,.Клинические бактериологические наблюдения синдрома токсического шока, вызванного Streptococcus pyogenes
,N Engl J Med
,1987
, vol.317
(стр.146
—9
) 5.,,, И др.Тяжелая стрептококковая инфекция группы А, связанная с синдромом токсического шока и токсином скарлатины A
,N Engl J Med
,1989
, vol.321
(стр.1
—7
) 6.,,, Et al.Клональная основа возобновления серьезного заболевания Streptococcus pyogenes в 1980-е годы
,Lancet
,1992
, vol.339
(стр.518
—21
) 7.,,,,,.Streptococcus pyogenes , вызывающий токсин-шоковый синдром и другие инвазивные заболевания: клональное разнообразие и экспрессия пирогенного токсина
,Proc Natl Acad Sci USA
,1991
, vol.88
(стр.2668
—72
) 8.,,,.Аспекты патогенеза серьезных стрептококковых инфекций группы А в Швеции, 1988–1989 гг.
,J Infect Dis
,1992
, vol.166
(стр.31
—7
) 9., , , и другие.Инвазивные стрептококковые инфекции группы А в Онтарио, Канада. Онтарио Группа A Streptococcal Study Group
,N Engl J Med
,1996
, vol.335
(стр.547
—54
) 10.,,.Идентификация специфического рецептора плазмина на стрептококке группы А
,Infect Immun
,1987
, vol.55
(стр.1914
—28
) 11.,,,.Стрептококки, продуцирующие стрептокиназу, выращенные в плазме человека, приобретают нерегулируемую клеточно-ассоциированную активность плазмина
,J Infect Dis
,1992
, vol.166
(стр.436
—40
) 12.,.Активация плазминогена инвазивными патогенами человека
,Thromb Haemost
,1997
, vol.77
(стр.1
—10
) 13.,,.Захват плазмина (огена) хозяина: общий механизм инвазивного патогена
,Trends Microbiol
,1994
, vol.2
(стр.20
—4
) 14.,,.Роль фибриногена в зависимом от стрептокиназы приобретении плазмина (огена) стрептококками группы A
,J Infect Dis
,1995
, vol.171
(стр.85
—92
) 15.,,,,.Идентификация продуктов ключевых генов, необходимых для приобретения плазминоподобной ферментативной активности стрептококками группы A
,J Infect Dis
,1997
, vol.175
(стр.1115
—20
) 16.,,.Анализ взаимодействия стрептококков группы А с фибриногеном, стрептокиназой и плазминогеном
,Microb Pathog
,1995
, vol.18
(стр.153
—66
) 17.,.Взаимодействие стрептококков группы А в плазме человека приводит к сборке поверхностного активатора плазминогена, который способствует заселению поверхностных плазминсвязывающих структур
,Microb Pathog
,1998
, vol.24
(стр.341
—9
) 18.,,,,,.Активаторы плазминогена, деградация тканей и рак
,Adv Cancer Res
,1985
, vol.44
(стр.139
—266
) 19.,,.Активатор плазминогена в раннем эмбриогенезе: продукция ферментов трофобластом и париетальной энтодермой
,Cell
,1976
, vol.9
(стр.231
—40
) 20.,,,.Измерение хемотаксиса лейкоцитов in vivo
,Методы Enzymol
,1988
, vol.162
(стр.101
—14
) 21.,.Связь между экспрессией G-связывающих иммуноглобулин белков стрептококками группы A и вирулентностью в модели кожной инфекции мышей
,Infect Immun
,1993
, vol.61
(стр.1378
—84
) 22.,,.Картирование домена плазмина человека, распознаваемого уникальным рецептором плазмина стрептококков группы A
,Infect Immun
,1989
, vol.57
(стр.2597
—605
) 23.,.Исследования плазминогена. VIII. Видовая специфичность стрептокиназы
,Can J Biochem
,1969
, vol.47
(стр.927
—31
) 24.,,.Хромогенный анализ для обнаружения плазмина, генерируемого активатором плазминогена, иммобилизованным на нитроцеллюлозе, с использованием синтетического пептидного субстрата para -нитроаналид
,Anal Biochem
,1989
, vol.177
(стр.78
—84
) 25.,,.Анализ приобретения плазмина (огена) клиническими изолятами стрептококков группы А, инкубированных в плазме человека
,J Infect Dis
,1994
, vol.169
(стр.143
—9
) 26.,,, И др.Влияние нарушения гена плазминогена на тромбоз, рост и здоровье мышей
,Circulation
,1995
, vol.92
(стр.2585
—93
) 27.,.Механизм активации плазминогена человека стрептокиназой
,J Biol Chem
,1972
, vol.247
(стр.1683
—91
) 28.,.Видовая специфичность стрептокиназы
,Comp Biochem Physiol [B]
,1983
, vol.75
(стр.389
—94
) 29.,,,.Дефицит плазминогена вызывает тяжелый тромбоз, но совместим с развитием и воспроизводством
,Genes Dev
,1995
, vol.9
(стр.794
—807
) 30.,,,,.Дефицит плазминогена по-разному влияет на набор популяций воспалительных клеток у мышей
,Кровь
,1998
, vol.91
(стр.2005
—9
) 31.,.Генетический анализ плазминогена и системы свертывания крови у мышей
,Гемостаз
,1996
, т.26
доп. 4
(стр.132
—53
) 32.,,, Et al.Восстановление тромболитического потенциала у мышей с дефицитом плазминогена болюсным введением плазминогена
,Кровь
,1996
, vol.88
(стр.870
—6
) 33.,.Нацеливание на гены и исследования переноса генов биологической роли системы плазминоген / плазмин
,Thromb Haemost
,1995
, vol.74
(стр.429
—36
) 34.,,,,,.Плазминоген необходим для эффективного распространения B. burgdorferi у клещей и для усиления спирохетемии у мышей
,Cell
,1997
, vol.89
(стр.1111
—9
) 35.,,,,,.Поверхностная протеаза и инвазивный характер бляшки
,Science
,1992
, vol.258
(стр.1004
—7
) 36., , , и другие.Мыши с дефицитом плазминогена обладают повышенной устойчивостью к бляшкам [аннотация]
,Микробы, гемостаз и сосудистая биология (Галвестон, Техас)
,1998
Вашингтон, округ Колумбия
Американское общество микробиологии
37.,,, et al.Урокиназа необходима для воспалительного ответа легких на Cryptococcus neoformans . Модель трансгенных мышей
,J Clin Invest
,1996
, vol.97
(стр.1818
—26
)Заметки автора
© 1999 Американского общества инфекционных болезней
203. Побочная история: Эпилог Огена
С этой побочной историей у нас , по сути, закончено с этими побочными историями «помогите знакомому лицу». Я имею в виду, что технически у нас есть еще два таких, но они будут немного отличаться от того, что мы видели.
А пока давайте посмотрим, чем был занят Оген.
ТИШИНА
Однако, если лихорадка вернется, принимайте это дважды в день, пока она не спадет.
Большое спасибо. Нам так повезло, что через нашу деревню прошел такой опытный аптекарь.
Нет нужды в благодарности. Это моя работа.
Эм, сэр, могу я спросить …
Не то чтобы я помню, но я много передвигаюсь.
Я чувствовал себя так, как будто встречал тебя раньше.Давным-давно.
Может быть. Как я уже сказал, я много двигаюсь.
Но когда я потерял жену, я уехал отсюда. После этого я долгое время был в разъездах. Однако после всех этих лет … Думаю, меня просто поразила эта фантазия, и я подумал, что заеду, посмотрю это старое место.
Мелисса … Скоро будет годовщина того дня, когда я потерял тебя.
Здесь Оген жил со своей женой перед ее трагической смертью.Между его бесцельными путешествиями и всем, что происходило в последнее время, он, вероятно, в последнее время много больше думал о ней, что могло прямо или косвенно привести его сюда.
Музыка: Town Veiled in White
Итак, конечно, у него есть проблема, с которой мы ему поможем.
Но, похоже, они здесь больше не растут.
По сути, мы должны найти Оген определенного вида цветов.Но где?
Victors Hollow, конечно же! Почему? Почему нет!
Взгляните на этот прекрасный Mind-Me-Always! Я нашла только этот цветок высоко в горах!
Эта Цветочница действительно любит свои цветы, хотя немногие, кажется, ценят их так же, как она.
В любом случае, мы получили то, что нам нужно, остальное вы знаете.
Моя жена любила их больше всего.Спасибо …
Музыка: окутанная добротой
Я сунул вам несколько таких, когда сделал вам предложение, стоя в поле за деревней …
………
Все это время я бродил в поисках причины, чтобы жить дальше.
Я еще некоторое время буду помогать людям в качестве аптекаря. Так что я не приду к вам, как только подумал.Я надеюсь, ты будешь присматривать за мной … и ждать, пока я приду к тебе …
Он тот, кто напомнил мне, что на самом деле значит быть аптекарем.
Итак, Оген получил некоторую необходимую завершенность и душевное спокойствие.
Если вам когда-нибудь понадобится помощь, приходите ко мне.
Надеюсь, он сможет помочь еще большему количеству людей в будущем!
В следующий раз мы сразимся с нашим самым грозным противником, пока мы сразимся с самым сложным побочным боссом в игре, по крайней мере, за пределами последнего босса! Это будет непросто…
IJMS | Бесплатный полнотекстовый | Взаимодействие тромбин-фибрин (оген), защита хозяина и риск тромбоза
2. Взаимодействие тромбин-фибрин во время образования сгустка
Еще в 1945 году было замечено, что тромбин адсорбируется из свободного раствора на фибрин [9]. Таким образом, фибрин рассматривался как ингибитор тромбина и был назван «антитромбином 1» [10]. Это, однако, только одна сторона медали, так как фибрин можно также назвать протектором тромбина. Взаимодействия тромбин-фибрин, описанные в данном параграфе, в основном основаны на экспериментах по образованию тромбина, как описано Hemker et al.[11]. Короче говоря, концентрацию тромбина в свертывающейся плазме контролируют путем расщепления небольшого флуорогенного субстрата и сравнения его с постоянной известной активностью тромбина в параллельном образце, не свертывающемся со свертыванием. В плазме свертывания есть два отсека: сгусток и окружающая жидкость. Если флюорогенный субстрат добавлен к плазме свертывания, то можно измерить активность тромбина как в сгустке, так и в окружающей жидкости [12]. Путем отбора пробы из окружающей жидкости будет измеряться активность тромбина только в этом отсеке [13,14].Независимо от того, используется ли метод подвыборки или измеряется непрерывная активность тромбина в обоих компартментах, имеет большое значение для интерпретации результатов, как будет обсуждаться ниже. В обоих типах экспериментов субстрат тромбина с низкой молекулярной массой используется для контроля активности тромбина. Такие субстраты преобразуются не только свободным тромбином, но также тромбином, связанным с ингибитором α2-макроглобулина (A2M). В то время как антитромбин и другие ингибиторы сериновой протеазы (серпины) связываются с активным сайтом тромбина и, таким образом, блокируют любую дальнейшую активность, A2M представляет собой большой белок (800 кДа), который поглощает тромбин и, таким образом, предотвращает его действие на любой белок, включая фибриноген [15] .Однако активный центр тромбина остается в функциональном состоянии, так что субстраты с малой молекулярной массой все еще могут расщепляться. Таким образом, измеренная активность тромбина в анализах образования тромбина может быть отнесена к свободному и связанному с A2M тромбину [16]. Математическая процедура позволяет по отдельности оценивать динамику содержания свободного тромбина и комплекса А2М-тромбин [16]. Роль фибрина можно узнать, сравнивая ту же плазму с фибриногеном и без него. Фибриноген можно удалить из плазмы, не влияя на систему свертывания, путем образования сгустка в цитратной плазме путем добавления определенных ферментов из ядов змей, таких как анкрод [17] или агихал [18], и разматывания сгустка.На рисунке 1а видно, что в эксперименте, в котором измеряются оба отсека, в присутствии сгустка измеряется гораздо больше активности тромбина, чем в его отсутствие [19]. Напротив, когда тромбин измеряется только в жидкостном отсеке (рис. 1b), значительно меньшая активность тромбина достигается в присутствии сгустка [20]. Должно быть значительное количество тромбина, адсорбированного на сгустке и более устойчивого к инактивации, чем тромбин в свободном растворе. Это также подтверждается различиями в распаде тромбина между нормальной и дефибринированной плазмой.Общий распад тромбина значительно медленнее в присутствии фибринового сгустка, как показано в таблице 1. Инактивация тромбина происходит из-за образования комплекса с серпинами и A2M. Оба ингибитора работают лучше в дефибринированной плазме, что видно по увеличению A2M- и серпин-зависимых констант распада в таблице 1. В экспериментах по подвыборке (рис. 1b) видно, что спады спада в нормальной и дефибринированной плазме совпадают, что позволяет предположить, что распад тромбина в на жидкостный отсек не влияет наличие фибринового сгустка.Следовательно, различия, показанные в таблице 1, должны быть связаны с медленным распадом тромбина в отделе сгустка. Скорее всего, это связано с диффузионным ограничением взаимодействия между ингибиторами и тромбином, связанным с фибрином. Тот факт, что различия гораздо более очевидны для большой молекулы A2M (800 кДа), чем для более мелких серпинов (например, антитромбин III; 58 кДа), подтверждает это объяснение. Существует несколько сайтов связывания тромбина на молекуле фибриногена. Наиболее заметные участки связывания фибриногена — это участки, где фибринопептиды отщепляются, что приводит к образованию мономеров фибрина.Эти уязвимые сайты связывания ipso facto исчезают при образовании фибрина. Превращение тромбина в фибриноген предотвращает превращение субстрата в анализе образования тромбина. Это объясняет временное падение активности тромбина в жидкой фазе в момент свертывания (рис. 1b) и отставание в появлении измеримой общей активности тромбина (рис. 1a). На фибрине остаются обратимые сайты связывания с низким сродством в Е-домене (K a = 0,29 × 10 6 ) и сайт связывания с высоким сродством в γ ’цепи (K a 4.9 × 10 6 ) [21]. Тромбин имеет несколько сайтов связывания для своих лигандов; экзосайт I, также называемый фибриноген-связывающим экзосайтом, и экзосайт II, основной сайт связывания ингибитора тромбина [22]. Тромбин связывается с γ ’фибрином через экзосайт II, делая вероятной доступность амидолитического центра (экзосайта I) для дальнейшего расщепления фибриногена [23]. Цепь γ ’представляет собой альтернативно сплайсированный вариант γ-цепи, который встречается примерно в 15% всех молекул фибриногена [24]. Более многочисленная цепь γ обозначается как γA.Следовательно, существует три формы фибриногена (и фибрина): γA-γA (85%), γA-γ ‘(15%) и γ’-γ’ (25). Вероятно, что защитное действие фибрина на тромбин прямая связь с составом γ-цепи демонстрируется наблюдением, что фибриноген-зависимое увеличение образования тромбина меньше для γA-γA фибрина, чем для γA-γ ‘фибрина, пропорционально концентрации последнего [26]. , ингибирующее действие A2M на тромбин во время свертывания крови более выражено в дефибринированной плазме с добавлением фибриногена γA-γA по сравнению с фибриногеном γA-γ ‘[26].Это показывает, что в присутствии γ ’фибрина меньше свободного тромбина доступно для ингибирования с помощью A2M. Таким образом, фибрин действительно защищает тромбин от инактивации, и этот эффект в первую очередь связан с тем, что A2M имеет ограниченный доступ к молекулам тромбина, связанным с цепями γ ‘. Взаимодействия тромбина с фибрином не только замедляют распад тромбина естественными ингибиторами, но также влияют на превращение протромбина. Кривая скорости превращения протромбина может быть рассчитана из константы распада тромбина в плазме и кривой образования тромбина [26].Затем видно, что превращение протромбина в отсутствие фибрина ниже (± 15%), чем в присутствии фибрина, независимо от типа присутствующего фибрина. В соответствии с этим наблюдением уровень протромбина в сыворотке (после образования сгустка) был ниже в присутствии фибрина, чем в его отсутствие, 89 ± 11 нМ против 172 ± 33 нМ (среднее ± стандартное отклонение), соответственно [26]. Это указывает на более эффективное превращение протромбина в присутствии фибринового сгустка. Предварительное объяснение может заключаться в том, что в присутствии фибринового сгустка скорость образования тромбина определяется не химическими процессами, а диффузией [27].Из-за диффузии в плоскости поверхности фосфолипидов, на которой адсорбируется комплекс протромбиназы (и, по аналогии, предположительно, комплекс теназы), превращение протромбина тем быстрее, чем больше поверхность фосфолипида [28]. Считается, что фосфолипиды микрочастиц тромбоцитов распространяются по волокнам фибрина [29]. Следовательно, присутствие волокон может увеличить доступную поверхность прокоагулянтного фосфолипида и, следовательно, его эффективность по преобразованию протромбина.Следует понимать, что в присутствии фибринового сгустка физические процессы, такие как поток и диффузия, не менее важны, чем биохимические взаимодействия между молекулами.Например, локализация активного тромбина в сгустке частично является результатом связывания с фибрином, но также происходит из-за эффекта губки, то есть потому, что внутри сгустка нет потока. В совокупности процесс образования тромбина в присутствии фибриновой ткани может полностью отличаться от процесса в растворе.
Остается вопрос о биологической функции тромбина, связанного со сгустком. Как упоминалось ранее, ингибирование тромбина A2M устраняет все биологические функции in vivo, но делает возможным преобразование субстрата in vitro.Однако, похоже, что связанный с фибрином тромбин сохраняет свои биологические функции. Основополагающие эксперименты Бьюкенена, которые привели к открытию тромбина (anno 1836), нельзя объяснить, кроме как предположением, что тромбин адсорбируется на сгустке, остается активным в течение ночи, может быть извлечен из сгустка и затем индуцирует свертывание в течение ночи [30]. . Кроме того, сгустки, полученные путем рекальцификации плазмы и тщательно промытые до тех пор, пока промывочная жидкость не будет лишена какой-либо обнаруживаемой активности тромбина, сокращают зависящее от фактора Va время задержки образования тромбина во внешней системе, а также время задержки фактора VIIIa- зависимая генерация тромбина во внутренней системе [20].Препараты фактора V или фактора VIII, которые сами по себе практически не влияют на характер образования тромбина, приобретают способность сокращать время задержки при инкубации с промытыми фибриновыми сгустками. Вызванные змеиным ядом сгустки, лишенные фибрина, в этом отношении неактивны, как и последняя промывочная жидкость этих плазменных сгустков. Сгустки, которые инкубируются в гепаринизированной плазме, столь же активны, как и сгустки из нормальной плазмы. Похоже, что связанный со сгустком тромбин остается способным активировать факторы V и VIII.Роль фактора Ха, связанного со сгустком, нельзя исключить, но она должна быть незначительной, потому что сгусток, образованный добавлением тромбина в плазму, из которого были удалены факторы II, VII, IX и X, так же активен, как сгусток из нормальной плазмы [20 ]. Помимо активации факторов свертывания крови, было показано, что фибриновые сгустки (независимо от наличия тромбина) провоцируют прокоагулянтную активность тромбоцитов. Хотя тромбин, связанный со сгустком, не обязательно был необходим для этого явления, тромбин значительно усиливает это увеличение [31].Таким образом, фибрин не действует как антитромбин, но удаляет тромбин из свободного раствора путем адсорбции. Адсорбированный тромбин защищен от антитромбинов, особенно от А2М. Он остается физиологически активным, поскольку может активировать факторы V, VIII и тромбоциты.
3. Фибриноген и защита хозяина
Фибриноген может повышаться до 10 г / л при тяжелых воспалительных состояниях. Это увеличение не обязательно связано с его гемостатической функцией, поскольку физиологические концентрации фибриногена (2.0–4,0 г / л) достаточно для этой цели. Однако увеличение количества реагента острой фазы может отражать его иммунологические функции. Иммунная и гемостатическая системы тесно взаимосвязаны [32], причем первичная гемостатическая защитная функция заключается в физическом «захвате» и, как следствие, секвестрации патогенов. Активность тромбина была связана с улучшением выживаемости после бактериальной инфекции на нескольких моделях мышей [33,34,35]. Хотя частично этот эффект обусловлен активацией тромбоцитов тромбином через PAR1 (протеазно-активированный рецептор 1), опосредованное тромбином отложение фибрина является основным защитным механизмом [33].Мыши с дефицитом фибриногена (Fg — / — ) демонстрируют повышенную бактериальную нагрузку, распространение и смертность по сравнению с мышами дикого типа или гетерозиготными (Fg +/- ) мышами [33,34,36,37]. Кроме того, мыши, у которых нормальный уровень фибриногена, но вырабатывают меньше фибрина из-за лечения антикоагулянтами (антагонист витамина К; VKA или дабигатран), демонстрируют повышенную смертность, связанную с инфекциями [33,36,37]. Полезен ли фибриноген после инфицирования, зависит как от патогена, так и от контекста.Фибриновая сеть играет решающую роль в защите от патогенов. Мыши с мутантной формой фибриногена, у которых отсутствует способность образовывать полимеры фибрина (Fib AEK ), демонстрируют снижение клиренса Staphylococcus aureus и выживаемость после внутрибрюшинной инфекции [38]. В других моделях мышей нокдаун фермента, ответственного за перекрестное связывание полимеризованного фибрина, фактора XIIIa, приводил к повышенной смертности и распространению инфекции после бактериальной инфекции [39,40]. Эти данные предполагают, что полимеризация фибрина имеет решающее значение для секвестрации и устранения патогенов.Тем не менее, образование фибриновых матриц не учитывает все антимикробные эффекты, опосредованные фибриногеном [38]. Помимо своей гемостатической функции, фибриноген является важным регулятором функции воспалительных клеток и врожденного иммунитета [34,41]. Фибриноген в первую очередь взаимодействует с рецептором Mac-1 (CD11b / CD18, CR3, αMβ 2 ), экспрессируемым на нейтрофилах и моноцитах / макрофагах [42]. Mac-1 демонстрирует широкое распознавание лигандов с более чем 40 различными белками, способными связываться с рецептором и активацией, включая комплемент (C3bi), ICAM-1 и фибрин (оген) [43,44].Описаны множественные сайты связывания в доменах γ-цепи фибриногена для Mac-1 [44,45,46,47]. Примечательно, что сродство Mac-1-фибриногена зависит от состояния фибриногена; связывающий мотив плохо экспонируется в растворимом фибриногене, но становится доступным для взаимодействия лейкоцитов после иммобилизации и в фибрине (как иммобилизованный фибриноген, так и фибрин далее вместе именуются иммобилизованным фибрином (оген) в этом абзаце) [48]. Этот механизм позволяет растворимому фибриногену плазмы оставаться в основном невидимым для циркулирующих лейкоцитов, хотя было предложено низкоаффинное взаимодействие с Mac-1.Эти различия между растворимым фибриногеном и иммобилизованным фибрином (огеном) уже стали очевидны в 1990 году, когда две исследовательские группы определили различные взаимодействия Mac-1, которые они не могли объяснить, не предполагая, что различные механизмы задействованы в зависимости от состояния фибриногена [49,50]. в целом иммобилизованный фибрин (оген) вызывает провоспалительный ответ, зависимый от Mac-1. [51] Взаимодействия иммобилизованного фибрина (оген) -Mac-1 приводят к активации клеток, о чем свидетельствует повышение внутриклеточного Ca 2+ , NF-ĸB и активации пути MAPK [41,52,53,54,55,56].Кроме того, как моноциты, так и нейтрофилы демонстрируют зависимое от иммобилизованного фибрина (оген) увеличение адгезии, миграции, фагоцитоза, дегрануляции, высвобождения цитокинов / хемокинов и задержки апоптоза [35,52,55,56,57,58,59,60,61 , 62]. Однако растворимый фибриноген является относительно плохим лигандом Mac-1 и не активирует и не индуцирует передачу сигналов в нейтрофилах [48,63]. Тем не менее, циркулирующий уровень растворимого фибриногена частично снижает воспалительную реакцию. Высокие концентрации растворимого фибриногена, присутствующие во время острофазовых реакций, дозозависимо снижают адгезию нейтрофилов в условиях потока [63,64].Эти наблюдения предполагают противоположные функции растворимого и иммобилизованного фибрина (огена), проиллюстрированные на фиг. 2. Даже несмотря на то, что растворимый фибриноген является плохим лигандом для Mac-1, предполагаемое низкоаффинное взаимодействие между ними может выполнять свою противовоспалительную функцию; насыщение рецептора Mac-1 в среде с высоким уровнем растворимого фибриногена может конкурировать с иммобилизованным фибрином (огеном) за активацию лейкоцитов, опосредованную Mac-1. Другая гипотеза рассматривает аутоингибиторный эффект растворимого фибриногена за счет связывания с его собственной иммобилизованной или преобразованной изоформой.Затем растворимый фибриноген образует защитный слой, который защищает иммобилизованный фибрин (оген) и препятствует адгезии и активации провоспалительных лейкоцитов [65]. Вместе растворимый фибриноген и иммобилизованный фибрин (оген) обладают парадоксальным действием, проявляя соответственно противовоспалительную и противовоспалительную реакцию. Важность фибриногена в системе защиты хозяина лучше всего иллюстрируется количеством бактериальных факторов, которые увеличивают вирулентность путем уклонения. из-за опосредованного фибрином захвата. Некоторые бактерии экспрессируют белки, индуцирующие фибринолиз: стрептококки группы А продуцируют стрептокиназу, которая опосредует активацию фибринолитической системы хозяина через превращение плазминогена в плазмин [66,67].Эта бактериальная индукция фибринолиза приводит к дальнейшей инвазии из первичного очага инфекции и распространению в другие органы [68]. Другой пример — поверхностная протеаза «Pla», продуцируемая Yersinia pestis, которая вызывает разрушение сгустка и вызывает распространение бактерий и, следовательно, молниеносную чуму [69]. Таким образом, бактериальная вирулентность увеличивается, когда бактерии могут вторгаться и распространяться, вырываясь из сгустка, возникающего в результате активации гемостаза в месте инфекции. Напротив, некоторые бактерии используют фибриноген в свою пользу: Staphylococcus aureus, наиболее частая причина инфекционного эндокардита. характеризуется образованием тромбов, состоящих из тромбоцитов, фибрина и бактерий [70,71].S. aureus, как известно, захватывает систему свертывания крови хозяина, образуя щит, защищающий ее от выведения иммунными клетками. Два хорошо описанных фактора вирулентности — это (стафило) коагулаза и фактор слипания А (ClfA). Стафилкоагулаза образует комплекс 1: 1 с протромбином, в котором активный центр, скрытый в протромбине, становится открытым [72]; следовательно, комплекс способен превращать фибриноген в фибрин. Кроме того, стафилкоагулаза реагирует с дез-гамма-карбоксипротромбином (белок, индуцированный отсутствием витамина K II; PIVKA-II) [73].PIVKA-II производится в отсутствие витамина K и не содержит дикарбоксильной группы, необходимой для закрепления через Ca 2+ на фосфолипидном слое. Следовательно, тромбин образуется медленнее, что желательно у пациентов, получающих антикоагулянты, такие как VKA. Однако стафилокоагулаза превращает PIVKA-II с той же скоростью, что и нормальный протромбин [74]. Следовательно, обычные антикоагулянты не могут сдерживать коагулянтную активность в присутствии стафилкоагулазы. Комплекс между стафилокоагулазой и протромбином способен преобразовывать субстраты тромбина с низкой молекулярной массой [75].Следовательно, низкомолекулярные псевдосубстраты (например, прямые пероральные антикоагулянты; DOAC), которые ингибируют тромбин, могут блокировать активный центр этого комплекса и предотвращать дальнейшее превращение фибриногена. Способность коагулаз индуцировать опосредованное протромбином превращение фибриногена и связывать фибриноген способствует образованию бактериального щита [76]. Другой фактор вирулентности, фактор слипания γ-цепи фибриногена, связывающий белок A (ClfA), опосредует адгезию бактерий к эндотелиальным клеткам в условиях сдвига фибриноген-зависимым образом [77,78].Кроме того, образование фибриногенной «оболочки» препятствует фагоцитозу и может активировать тромбоциты за счет взаимодействия с интегрином тромбоцитов αIIbβ3, способствуя образованию тромба [79,80,81]. Кроме того, как следует из названия, ClfA опосредует бактериальное «слипание», что приводит к фенотипическому изменению от первично адгезивной бактерии к цитотоксической и инвазивной бактерии [82]. Эти фибриноген-зависимые характеристики способствуют распространению бактерий, проникновению в органы и, следовательно, вирулентности. В самом деле, мыши, экспрессирующие мутантные формы фибриногена, сохраняющие функцию свертывания, но лишенные мотива связывания ClfA, демонстрируют сниженную бактериальную нагрузку и повреждение органов [83].Когда мышей инфицировали Lactococcus lactis, экспрессирующим мутантный ClfA, неспособный связывать фибриноген, как диссеминация, так и смертность были снижены по сравнению с мышами, инфицированными Lactococcus lactis, несущими нормальный ClfA [84]. Другой пример включает белок M1 стрептококков группы A, который связывает фибриноген. На бактериальной поверхности связывание фибриногена с M1 запрещает фагоцитарную элиминацию стрептококков группы A нейтрофилами, поскольку фибриноген блокирует отложение антител и комплемента [85,86].Кроме того, свободный M1, высвобождаемый протеазами нейтрофилов, образует перекрестно-подобную сеть паттернов с фибриногеном [87]. Сеть M1-фибриноген способна активировать нейтрофилы и запускать высвобождение связывающего гепарин белка, способствуя проницаемости сосудов [88]. Фибриноген благоприятствует стрептококкам группы А, образуя сеть, которая стимулирует утечку из сосудов и препятствует элиминации фагоцитов. Таким образом, дефицит фибриногена может препятствовать распространению бактерий и вирулентности после заражения патогенами, экспрессирующими фибриноген-связывающие белки, несмотря на ранее описанные антимикробные характеристики этого белка свертывания.С точки зрения хозяина, фибриноген в основном выполняет защитные функции, являясь конечным продуктом свертывания крови и инициируя провоспалительную реакцию. Однако высокие уровни фибриногена в плазме могут сдерживать этот ответ, ограничивая рекрутинг лейкоцитов. Кроме того, факторы вирулентности бактерий могут экспрессировать белки, которые опосредуют уклонение от фибриногена или используют его для стимулирования распространения и вирулентности. Таким образом, полезен ли фибриноген после инфицирования, зависит как от патогена, так и от контекста.Острая фазовая реакция и последующее повышение фибриногена в плазме могут защитить хозяина от побочного повреждения, вызванного воспалительной реакцией, в отличие от локально иммобилизованного фибрина (огена), который отмечает место инфекции и / или повреждения сосудов.
В физиологических условиях отложения фибрина в основном развиваются во внесосудистом матриксе для восстановления целостности сосудов, маркируют пораженный участок для лейкоцитов и вызывают соответствующую воспалительную реакцию как элемент процесса заживления ран.Однако чрезмерное отложение иммобилизованного фибрина (огена) было описано в патофизиологических условиях. Фибриноген — один из наиболее распространенных гемостатических факторов, связанных с развитием атеросклероза [89]. Атеросклеротические поражения, присутствующие в интиме стенок кровеносных сосудов и хорошо известные предвестники сердечно-сосудистых тромботических событий, содержат большое количество фибриногена [90]. Большая часть фибриногена в бляшках сшита тканевой трансглутаминазой и накапливается в виде иммобилизованных фибриноген-матриц, которые, как предполагается, защищены от превращения тромбина в фибрин [91].Это чрезмерное накопление нерастворимого фибриногена может быть вовлечено в низкую воспалительную реакцию, лежащую в основе атеросклеротической бляшки и последующего тромбоза. Это также подтверждается представлением о том, что нестабильные бляшки содержат больше фибриногена (фрагмент D), чем стабильные [92]. Кроме того, диссеминированное внутрисосудистое свертывание (ДВС) характеризуется продуманной активацией тромбина, приводящей к образованию внутрисосудистого сгустка и отложению фибрина [93]. Воспаление оказывает реципрокный эффект на коагуляцию (см. Ссылку [94]), например, на экспрессию IL-6-зависимого тканевого фактора.При ДВС-синдроме образуется порочный круг с воспалительными цитокинами, активирующими систему свертывания и, следовательно, отложением фибрина, еще более усугубляющим воспалительную реакцию.Помимо функции фактора свертывания крови, фибриноген, таким образом, оказывает плейотропное действие на иммунную систему: растворимый фибриноген ингибирует рекрутирование лейкоцитов, а иммобилизованный фибрин (оген) вызывает провоспалительный ответ через взаимодействия Mac-1. Высокий уровень фибриногена обычно препятствует распространению бактерий из очага инфекции.Однако некоторые бактерии экспрессируют факторы, которые опосредуют их вирулентность посредством взаимодействия с фибриногеном. Хотя взаимодействие фибриногена с иммунной системой зависит от контекста, оно важно для защиты хозяина.
4. Уровень фибриногена и риск тромботических заболеваний при воспалительных заболеваниях
В начале 80-х годов была впервые описана положительная связь между уровнем фибриногена в плазме и долгосрочным риском сердечно-сосудистых заболеваний [95,96]. В настоящее время принято считать, что фибриноген является независимым предиктором риска сердечно-сосудистых событий [97].Сообщалось также о роли фибриногена как фактора риска развития тромбов глубоких вен [98]. Несмотря на то, что повышенный тромботический риск повышенного уровня фибриногена хорошо известен, четкая причинная (генетическая) связь между уровнем фибриногена и тромботическим риском еще не обнаружена [99,100,101]. Воспалительные состояния вызывают гемостатические изменения и, как известно, являются предиктором тромбоза. . Эти изменения вызывают протромботическую тенденцию и состоят из увеличения прокоагулянтных факторов, ингибирования естественных антикоагулянтов и уменьшения фибринолиза [102].Таким образом, повышение фибриногена является единым целым в сложном взаимодействии коагуляции и воспаления. Следует проводить важное различие между острым и хроническим воспалением низкой степени. Хроническое воспаление характеризуется незначительным повышением вчСРБ (высокочувствительного С-реактивного белка), фибриногена и других воспалительных маркеров. Люди с заболеваниями, характеризующимися хроническим воспалением средней степени тяжести, такими как диабет и метаболический синдром, имеют более высокий уровень фибриногена и подвержены повышенному риску сердечно-сосудистых заболеваний [103,104,105,106].Острые воспалительные состояния отличаются друг от друга: в течение короткого периода времени маркеры воспаления значительно повышаются как компонент реакции острой фазы. Как описано ранее, фибриноген — это белок острой фазы, и его количество значительно увеличивается при таких патологиях. Пациенты с сепсисом, одним из наиболее выраженных острых воспалительных состояний, обычно имеют системный микротромбоз и повышенный риск венозных тромбоэмболий [107,108]. И хотя острые и хронические воспалительные состояния имеют существенно разные лежащие в основе патологии, они несут повышенный тромботический риск, имеют повышенные уровни фибриногена и активированную иммунную систему.Примечательно, что общий фибриноген в плазме не только повышается при воспалительных состояниях, но и изменяется состав фибриногена. Альтернативно сплайсированный γ ’фибриноген становится повышенным при хроническом и остром воспалении как в абсолютных количествах, так и в соотношении к общему фибриногену [109, 110, 111]. Как описано ранее, γ ’цепь содержит сайт связывания тромбина с высоким сродством. В соответствии с наблюдениями за образованием тромбина, можно было бы ожидать, что увеличение γ ’фибриногена связано с большим образованием тромбина и, возможно, с тромбозом.Фибриновые сгустки, полученные из очищенного γA-γ ’, демонстрируют структуру, которая ранее была связана с тромботическим риском: уменьшенный средний диаметр волокна, увеличенное ветвление и уменьшенный размер пор [112]. Несколько исследований сердечно-сосудистой системы показали связь между повышенным уровнем γ ’фибриногена и сердечно-сосудистыми событиями, которая не зависела от повышения общего фибриногена в плазме в некоторых исследованиях [113,114,115,116]. Следует отметить, что проспективные исследования в настоящее время отсутствуют, что затрудняет установление того, можно ли рассматривать повышение уровня γ ’фибриногена как причину или как следствие.На мышиной модели тромбоза сонной артерии инъекция γA-γA, а не γA-γ ’привела к большему тромбозу [117]. Кроме того, при корректировке на СРБ, первичный маркер воспаления, была устранена связь между γ ’фибриногеном и сердечно-сосудистыми заболеваниями. Эти результаты предполагают, что γ ‘фибриноген является общим маркером воспаления, а не независимым фактором риска сердечно-сосудистых заболеваний [115]. В отличие от артериального тромбоза более низкие соотношения γ’ фибриноген и γ ‘/ общий фибриноген у пациентов были связаны с повышенный риск венозного тромбоза и микроангиопатии, что свидетельствует о защитном эффекте γ ‘цепей [118, 119].Кроме того, на модели лейденского венозного тромбоза протромботического фактора V у мышей наблюдался умеренный защитный эффект после инъекции γA-γ ’фибриногена по сравнению с добавлением γA-γA фибриногена [120]. Однако это исследование не смогло воспроизвести аналогичный эффект у мышей дикого типа. В целом, точный тромботический риск, связанный с повышением уровня γ ’фибриногена в воспалительных условиях, в настоящее время неясен. Исследования in vitro продемонстрировали, что тромбин, связанный с сайтом связывания высокоаффинной γ ’цепи, обладал пониженной способностью к активации тромбоцитов и был неспособен связывать фибриноген [121, 122].Однако это не обязательно доказывает, что увеличение γ ’приводит к снижению активности тромбина in vivo. В циркуляции γ ’фибриноген может функционировать как депозитарий тромбина, где он остается защищенным от ингибирующих молекул и диффузии, но становится доступным для субстрата благодаря обратимому участку связывания [121].Как острое, так и хроническое воспаление характеризуется повышенным общим фибриногеном в плазме и соотношением γ ’фибриногена, хотя и в разной степени. Эксперименты по образованию тромбина с γ ’фибриногеном предполагают повышенный риск тромбоза при более высоких концентрациях этого альтернативно сплайсированного варианта фибриногена.Однако влияние γ ’фибриногена на риск артериальных и венозных тромбов остается неубедительным.
5. Синтез: уравновешивание воспаления и коагуляции
Тромбозам без исключения предшествует гемостаз и образование фибриновых матриц. Кроме того, эпидемиологические исследования неизменно связывают уровень фибриногена в плазме с риском тромбов, в частности атеротромбоза. Неудивительно, что считается разумным рассматривать все повышенные уровни фибриногена как протромботические маркеры.Однако повышение уровня фибриногена в плазме как реагента острой фазы при воспалительных состояниях может предотвратить воспалительный беспорядок и тромботические осложнения благодаря его уменьшающим иммунным свойствам. Можно предположить, что высокий уровень фибриногена в плазме сам по себе не вызывает тромбоза. С другой стороны, фибриновые матрицы могут вызвать порочный круг, который в некоторых случаях приводит к образованию тромба. Чрезмерное отложение фибрина может вызвать тромбоз с помощью двух механизмов положительной обратной связи: (1) тромбинозащитные характеристики фибриновых матриц дополнительно вызывают коагуляцию, (2) провоспалительная реакция, вызванная отложением фибрина, оказывает реципрокный стимулирующий эффект на коагуляцию.Этот сценарий предполагает, что людям с высоким уровнем фибриногена в плазме требуется второй удар, чтобы вызвать гемостаз и преобразовать «защитный» растворимый фибриноген в «протромботические» фибриновые матрицы. Несомненно, у человека не всегда развивается тромбоз, когда требуется восстановление сосудов путем гемостаза. Тромбозу обычно предшествует множество сигналов и сложных гемостатических изменений, в конечном итоге приводящих к неизбежному дисбалансу в сторону протромботического фенотипа. Таким образом, чрезмерное отложение фибрина может инициировать или усугубить этот дисбаланс из-за его тромбинозащитных и иммуностимулирующих свойств.
Этот сценарий стал очень актуальным во время недавней пандемии COVID-19, когда пациенты, инфицированные SARS-CoV-2, страдают коагулопатией, которая, в зависимости от тяжести заболевания, показывает значительное повышение уровня фибриногена, а также высокую частоту тромбоза легких. . Исходя из нынешней догмы, наблюдаемый высокий уровень фибриногена у пациентов с COVID-19 может быть связан с частым возникновением тромбозов. С другой стороны, Thachil предположил, что высокий фибриноген не обязательно вызывает тромбоз легких, а скорее защищает от него из-за его плейотропного действия на иммунную систему [123].Действительно, в продольном анализе тяжелобольных пациентов с COVID-19 низкий, а не высокий уровень фибриногена был связан с тромбоэмболией легочной артерии [124]. Это соответствует концепции, согласно которой высокие уровни фибриногена в плазме вызывают защитную функцию. Следует отметить, что тесты ex vivo позволяют оценить уровень фибриногена плазмы только in vivo. Следовательно, существует возможное несоответствие между измеряемым уровнем фибриногена в плазме и общим количеством как плазмы, так и иммобилизованного фибрина (оген). У пациента может быть несколько сценариев.Один сценарий рассматривает связанное с ДВС истощение фибриногена плазмы; измерения фибриногена могут быть низкими, но обильные микротромбы предполагают отложение большого количества фибрина. Другой сценарий включает связанное с беременностью повышение уровня фибриногена в плазме, которое не приводит к резкому отложению фибрина. У пациентов с COVID-19 увеличение ряда маркеров, включая D-димер и протромбин 1 и 2, подтверждает наличие отложения фибрина [125]; в сочетании с высокими уровнями фибриногена в плазме это иллюстрирует третий сценарий, в котором усиливаются как растворимый, так и иммобилизованный компартменты фибриногена.Взятые вместе, уровни фибриногена в плазме, измеренные с помощью анализов ex vivo, вряд ли надежно отражают иммобилизованный компартмент и общий фибриноген. Несоответствие между измеряемым растворимым фибриногеном и неизмеримым иммобилизованным фибрином (огеном) затрудняет анализ индивидуального действия этих отдельных компонентов фибриногена.Фибриноген, как и тромбин, участвует не только в гемостазе, но и выполняет множество плейотропных эффектов, включая иммунную модуляцию. Высокий уровень фибриногена в плазме может защитить пациентов во время острых воспалительных патологий благодаря своей иммунной уменьшающей функции.Фибриновые матрицы не являются просто пробкой, являющейся результатом гемостаза и тромбоза, они вызывают прокоагулянтный ответ, как напрямую, защищая тромбин при его включении в сгусток, так и косвенно через иммунную систему. Фибриноген участвует в сложном балансировочном действии между тромбином, растворимым фибриногеном плазмы и отложившимися фибриновыми матрицами.




 Ведение реестра осуществляется Федеральной… … Википедия
Ведение реестра осуществляется Федеральной… … Википедия Порядок открытия лицевых счетов Порядок ведения лицевых счетов исчисленных… … Энциклопедия инвестора
Порядок открытия лицевых счетов Порядок ведения лицевых счетов исчисленных… … Энциклопедия инвестора Усыновление (удочерение) детей –… … Энциклопедия ньюсмейкеров
Усыновление (удочерение) детей –… … Энциклопедия ньюсмейкеров Это могут быть не только цифры, но и заглавные буквы латинского алфавита от A до Z.
Это могут быть не только цифры, но и заглавные буквы латинского алфавита от A до Z.